时间:2020-07-07 23:33:01
1、选择题 设NA表示阿伏加得德罗常数的数值,下列叙述中正确的是? (? )
A.1mol NH3所含有的原子数为NA
B.常温常压下,22.4L氧气所含的原子数为2NA
C.常温常压下,48g O3所含的氧原子数为3NA
D.1 L 0.1mol/LNaCl溶液中所含的Na+为NA
2、填空题 硫酸试剂瓶标签上的部分内容如图。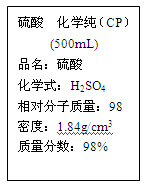
据此回答下列问题:
(1)该硫酸的物质的量浓度为 mol/L。
(2)配制250mL 0.50mol·L-1的稀硫酸需取该硫酸 mL。
(3)配制时必需的玻璃仪器有: 。
(4)定容时,若加入的水超过刻度线,必须采取的措施是 。
(5)下列操作会使所配溶液浓度偏低的是 。
A.转移溶液时,未洗涤烧杯
B.容量瓶用蒸馏水洗净后仍残留蒸馏水
C.定容时,俯视容量瓶的的刻度线
D.定容摇匀后,发现液面低于刻度线,再加水至刻度线
3、选择题 4g NaOH溶于水配成50mL溶液,溶液的物质的量浓度是
A.2mol/L
B.0.2 mol/L
C.1 mol/L
D.0.1 mol/L
4、选择题 等质量的下列物质中,所含分子数最少的是
[? ]
5、选择题 下列溶液中的C1-的物质的量浓度与150.0mL l.0 mol/L CaCl2溶液中的Cl-物质的量浓度相等的是
A.150 .0mL 1 .0 mol/L NaCl溶液
B.75 .0mL 2.0 mol/L MgCl2溶液
C.150 .0mL 2 .0 mol/LKCl溶液
D.75.0 mL 1 .0 mol/L A1C13溶液