时间:2020-07-07 23:24:33
1、选择题 将磁性氧化铁放入稀HNO3中可发生如下反应:3Fe3O4+28HNO3=9Fe(NO3)x+ NO↑+14H2O 。下列判断合理的是
[? ]
A.Fe(NO3)x中的x为2
B.反应中每生成0.2 mol 还原产物,就有0.6 mol 电子转移
C.稀HNO3在反应中只作氧化剂
D.磁性氧化铁中的铁元素全部被氧化
参考答案:B
本题解析:
本题难度:一般
2、选择题 下列反应中,水作氧化剂,且该反应属于置换反应的是:(?)
A.H2O+Cl2 ="HCl" +HClO
B.2H2O  2H2↑ +O2↑
2H2↑ +O2↑
C.2Na + 2H2O =" 2NaOH" +H2↑
D.2F2 +2H2O =" 4HF" + O2
参考答案:C
本题解析:A 水既不是氧化剂,也不是还原剂
B 此反应是分解反应,不是置换反应
C 水是氧化剂,且是置换反应
D 水是还原剂。故选C 。
本题难度:一般
3、选择题 下列反应中氯元素被氧化的是
[? ]
A.5Cl2+I2+6H2O===10HCl+2HIO3
B.2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O
C.MnO2+4HCl===MnCl2+2H2O+Cl2↑
D.2NaCl+2H2O2 NaOH+Cl2↑+H2↑
NaOH+Cl2↑+H2↑
参考答案:D
本题解析:
本题难度:一般
4、选择题 已知R有多种化合价,其最高正价为+7价。在一定条件下,RO3-与R-可发生反应:RO3-+5R-+6H+=3R2+3H2O,下列关于R元素的叙述中,正确的是(?)
A.元素R位于周期表中第VA族
B.RO3-中的R只能被还原
C.R-离子的最外层电子数为8
D.若1 mol RO3-参与该反应,则转移的电子的物质的量为5mol
参考答案:CD
本题解析:主族元素的最高正价=主族序数,R的最高正价是+7价,则R位于第VIIA族,故A错;由于氧元素显—2价,则RO3-中R的化合价为+5,既能升为+7价,也能降为0价等,因此RO3-中R既能被氧化,又能被还原,故B错;由于原子的最外层电子数=最高正价,则R原子最外层电子数=7,R原子得到1个电子变为R-,则R-中最外层电子数为8,故C正确;R元素由+5价降为0价,化合价降低总数为5,则转移电子数为5,反应:RO3-+5R-+6H+=3R2+3H2O~5e-中转移电子与RO3-的系数之比等于物质的量之比,则1 mol RO3-参与该反应,则转移的电子的物质的量为5mol,故D正确。
本题难度:一般
5、选择题 对于反应3Cl2+6NaOH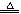 5NaCl+NaClO3+3H2O,以下叙述正确的是(?)
5NaCl+NaClO3+3H2O,以下叙述正确的是(?)
A.Cl2是氧化剂,NaOH是还原剂
B.被氧化的氯原子和被还原的氯原子的物质的量之比为5∶1
C.Cl2既做氧化剂又做还原剂
D.氧化剂得电子数与还原剂失电子数之比为5∶1
参考答案:C
本题解析:略
本题难度:简单