时间:2020-07-07 23:23:52
1、选择题 室温时,向10mL的醋酸稀溶液中逐滴滴入NaOH稀溶液至过量,有关叙述正确的是
A.实验过程中水的电离程度的变化是先减小后增大
B.当溶液呈中性时,反应恰好完全
C.当反应恰好完全时,消耗NaOH溶液10mL
D.当溶液呈碱性时,其中离子浓度由大到小的顺序可能为c(Na+)>c(OH-)>c(Ac-)>c(H+)
参考答案:D
本题解析:当氢氧化钠过量时,抑制水的电离,A不正确;醋酸和氢氧化钠恰好反应时,生成的醋酸钠水解,溶液显碱性,B不正确;由于不能确定水解溶液的浓度,因此不能确定消耗氢氧化钠溶液的体积,C不正确;D中符合电荷守恒,正确,答案选D。
点评:该题属于基础性试题,难度不大。重点考查外界条件对水的电离平衡的影响。溶液中离子浓度大小比较。在比较溶液中离子浓度大小时,关键是利用好几个守恒关系,即电荷守恒、物料守恒和质子守恒。
本题难度:一般
2、选择题 酸雨是因为过度燃烧煤和石油生成的硫和氮的氧化物溶于水变成HNO3和H2SO4。分析某次雨水数据如下:c(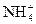 )=2.0×10-6 mol·L-1,c(Cl-)=6.0×10-6 mol·L-1,c(Na+)=3.0×10-6 mol·L-1,c(
)=2.0×10-6 mol·L-1,c(Cl-)=6.0×10-6 mol·L-1,c(Na+)=3.0×10-6 mol·L-1,c(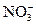 )=2.3×10-5 mol·L-1,c(
)=2.3×10-5 mol·L-1,c(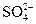 )=3.8×10-5 mol·L-1,则此次雨水的pH约为(?)
)=3.8×10-5 mol·L-1,则此次雨水的pH约为(?)
A.3
B.4
C.5
D.6
参考答案:B
本题解析:根据电荷守恒,c(H+)+c(Na+)+c(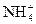 )=c(Cl-)+c(
)=c(Cl-)+c(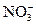 )+2c(
)+2c(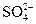 ),可求c(H+)。
),可求c(H+)。
本题难度:简单
3、选择题 下列热化学方程式表达正确的是(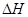 的绝对值均正确)
的绝对值均正确)
A.C2H5OH(1)+3O2(g)=2CO2(g)+3H2O(g)△H="
参考答案:
本题解析:
本题难度:一般
4、选择题 有甲、乙、丙3瓶等体积、等物质的量浓度的硫酸。若将甲用水稀释,在乙中加入少量的BaCl2溶液,丙保持原状,然后用等浓度的NaOH溶液滴定,至恰好完全反应时,所需NaOH溶液的体积关系是(?)
A.丙 甲
甲 乙
乙
B.丙=甲 乙
乙
C.乙 丙
丙 甲
甲
D.甲=乙=丙
参考答案:D
本题解析:
试卷分析:对于三瓶溶液分别进行加水稀释,加少量BaCl2溶液和维持现状处理,但是这些处理方法都不影响H+的物质的量,所以中和滴定时消耗NaOH溶液的体积相同。答案选D。
点评:本题用守恒法解更简单。
本题难度:一般
5、填空题 (6分)(1)已知天然气和水蒸气反应的热化学方程式为:CH4(g) + H2O(g)  ?CO(g)+ 3H2(g) ?ΔH =+206.4kJ·mol-1,则制得56g CO需要吸收的热量为??kJ;
?CO(g)+ 3H2(g) ?ΔH =+206.4kJ·mol-1,则制得56g CO需要吸收的热量为??kJ;
(2)CO可继续与水蒸气反应:CO(g)+H2O(g) CO2(g)+H2(g) ΔH =-41.0kJ·mol-1 ,若将1mol CH4与足量水蒸气充分反应得到1molCO2,该反应的焓变ΔH =?kJ·mol-1。
CO2(g)+H2(g) ΔH =-41.0kJ·mol-1 ,若将1mol CH4与足量水蒸气充分反应得到1molCO2,该反应的焓变ΔH =?kJ·mol-1。
参考答案:(6分)(1)412.8 (3分);?(2)+165.4 (3分)
(3分);?(2)+165.4 (3分)
本题解析:略
本题难度:一般