时间:2020-07-07 23:19:40
1、实验题 某活动小组设计了以下实验,其实验目的是观察两份完全相同的铁粉与铝粉的混合物分别与足量盐酸和NaOH溶液反应的删程;测定部分数据对混合物的成分进行定量分析。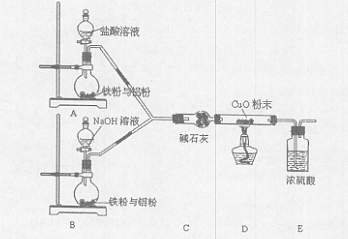
请回答:
(1)碱石灰的作用是?。
(2)下列操作进行的顺序由先到后的是?(填序号)。
①同时打开A、B中分液漏斗的活塞,分别加人足量试剂
②检查装置的气密性?③点燃酒精灯
④装入药品?⑤熄灭酒精灯
⑥同时关闭A、B中分液漏斗的活塞
(3)写出B装置中发生反应的离子方程式:?。
(4)写出装置A、B中实验现象的不同点?。
(5)该装置不够完善,还需增加的装置为?。
(6)已知反应前金属混合物的质量,发生反应后测定混合物成分的最简单方法是?。
(7)若混合金属中铁与铝的质量比为28:27,则充分反应后,A和B两烧瓶中转移电子总数之比为?。
参考答案:
本题解析:略
本题难度:一般
2、选择题 右图为实验室制氢气的简易装置。若在加稀硫酸时,发现锌粒与稀硫酸没有接触而稀硫酸不够了,为使该反应顺利进行,可以从长颈漏斗中加入的试剂是(?)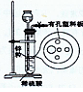
①食盐水?②KNO3溶液?③适量稀硫酸铜溶液
④Na2CO3溶液?⑤CCl4?⑥浓氨水
A.①③⑤
B.①②③
C.④⑤⑥
D.①②③⑤
参考答案:A
本题解析:
①食盐水,将稀硫酸稀释,液面上升?②KNO3溶液,与稀硫酸混合,相当于HNO3与Zn反应得不到H2?③适量稀硫酸铜溶液, 将稀硫酸稀释,液面上升,并产生Cu与Zn形成原电池,加快反应速率。④Na2CO3溶液与稀硫酸反应⑤CCl4,密度大于水,使液面上升?⑥浓氨水与稀硫酸反应。综上所述,答案为A。
本题难度:一般
3、填空题 为了确定HCl、C6H5OH及H2CO3的酸性强弱,有人设计了如图所示的装置进行实验:
(1)若锥形瓶中装有适量易溶于水的正盐固体,则A中发生反应的离子方程式为:______.
(2)装置B中盛放的试剂是______,它的作用是______.
(3)装置C中盛放的试剂是______,实验中观察到C中出现的主要现象是______,发生反应的方程式是______.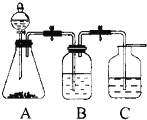
参考答案:(1)用盐酸和碳酸盐反应制取二氧化碳,锥形瓶装有适量易溶于水的正盐固体,所以反应发生的离子反应方程式为CO32-+2H+=CO2↑+H2O,故答案为:CO32-+2H+=CO2↑+H2O;
(2)碳酸盐和盐酸反应是放热反应,且盐酸具有挥发性,所以制取的二氧化碳中含有氯化氢气体,氯化氢也和苯酚钠反应而影响碳酸酸性的检验,所以二氧化碳和苯酚钠反应前要把氯化氢除去,且不能引进新的杂质,氯化氢和饱和的碳酸氢钠反应且二氧化碳不和饱和的碳酸氢钠反应,所以B选用饱和的碳酸氢钠溶液,
故答案为:饱和的碳酸氢钠溶液,吸收氯化氢;
(3)二氧化碳和苯酚钠溶液反应生成不溶性的苯酚,所以C选用苯酚钠溶液,反应现象是溶液变浑浊,反应方程式为C6H5ONa+H2O+CO2→C6H5OH+NaHCO3,
故答案为:苯酚钠溶液,溶液变浑浊,C6H5ONa+H2O+CO2→C6H5OH+NaHCO3.
本题解析:
本题难度:一般
4、实验题 (6分)据“网易新闻中心”报道,2008年12月13日,湖北大冶市金牛镇小泉村发生了群体中毒事件,三名儿童在送往医院途中死亡,另两名儿童至今日仍在医院治疗。经诊断,两儿童为灭鼠药“毒鼠强”急性中毒。此前的10月30日,湖北枣阳发生了三十四人的集体毒鼠强中毒事件;而震惊全国的湖北利川“十·二一”毒鼠强投毒案,曾造成三十五人中毒、十人死亡。毒鼠强的毒害是严重的,国家已禁止使用该药来消灭老鼠。那么什么是毒鼠强?它是一种含有C、H、O、N、S的有机物,其摩尔质量为240 g·mol-1,其中所含碳元素的质量分数为20%,所含氢元素的质量分数为3.3%,所含氧元素的质量分数为26.7%,所含氮元素的质量分数为23.3%,所含硫元素的质量分数为26.7%。根据以上各元素在其中所占的质量分数,试求各元素的物质的量之比为______,其化学式为______。
参考答案:n(C)∶n(H)∶n(O)∶n(N)∶n(S)=2∶4∶2∶2∶1 C4H8O4N4S2?
本题解析:根据物质的摩尔质量及各元素的质量分数,可计算出各元素的原子个数及化学式,设该物质1 mol,则质量为240 g。
n(C)==4 mol
n(H)==8 mol
n(O)==4 mol
n(N)==4 mol
n(S)==2 mol
则原子个数比n(C)∶n(H)∶n(O)∶n(N)∶n(S)=4∶8∶4∶4∶2=2∶4∶2∶2∶1。
化学式为C4H8O4N4S2。
本题难度:一般
5、选择题 金属钠不仅能跟氧气、水等无机物反应,还能跟酒精、醋酸等有机物反应.要研究金属钠跟酒精反应的性质以及它与水反应的异同点,下列研究方法中没有用到的是( )
A.实验法
B.观察法
C.分类法
D.比较法
参考答案:C
本题解析:
本题难度:简单