时间:2020-07-07 23:19:40
1、实验题 根据镁与二氧化碳的反应推测,钠也能在二氧化碳中燃烧,且固体产物可能为碳酸钠、氧化钠、碳中的两种或三种。某兴趣小组对钠在二氧化碳中燃烧后的产物进行定性和定量探究。
(1)假设产物为Na2CO3、Na2O和C的混合物,设计实验方案,验证其中的Na2CO3和Na2O。在答题卡上写出实验步骤、预期现象和结论。(已知室温时BaCO3饱和溶液的pH=9.6)
限选试剂及仪器:稀盐酸、BaCl2溶液、Ba(OH)2溶液、精密pH试纸(精确至0.1)、烧杯、试管、滴管、玻璃棒、表面皿、比色卡
| 实验操作 | 预期现象和结论 |
| 步骤1:取适量产物样品于洁净烧杯中,加入足量蒸馏水,充分搅拌,静置,取上层清液备用。 | 有不溶的黑色固体。 |
| 步骤2:取适量步骤1清液于试管中,? ? | ? ? |
| 步骤3:? ? | ? ? |
| 滴定 次数 | 待测溶液 的体积/mL | 消耗标准盐酸的体积 | |
| V1/mL | V2/mL | ||
| 1 | 25.00 | 15.02 | 4.97 |
| 2 | 25.00 | 14.98 | 5.03 |
| 3 | 25.00 | 13.21 | 6.75 |
2、选择题 随着现代化学的发展,出现了各种分析和测试物质结构、跟踪化学反应过程的技术。下列不属于现代化学研究重要手段的是
[? ]
A.X-射线?
B.天平?
C.质谱?
D.核磁共振
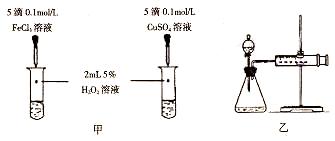
3、实验题 为了研究外界条件对H2O2分解速率的影响,某同学做了以下实验,请回答下列问题。
| 编号 | 操作 | 实验现象 |
| ① | 分别在试管A、B中加入5mL 5%H2O2溶液,各滴入2滴1 mol/L FeCl3溶液。待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中;将试管B放入盛有40℃左右热水的烧杯中。 | 试管A中产生气泡量减少;试管B中产生的气泡量增大。 |
| ② | 另取两支试管分别加入5mL 5%H2O2溶液和5mL 10%H2O2溶液 | 试管A、B中均未明显见到有气泡产生。 |
 ?
?
4、实验题 (14分)某化学课外研究小组拟对一种焰火原料(由两种短周期中的常见金属元素的单质组成的合金粉末)进行探究,请完成下列探究报告。
【探究目的】探究该焰火原料的成分
【资料检索】
(1)Mg2+检验方法:取2滴待测液,加入2滴2 mol·L-1NaOH溶液,再加入2滴镁试剂(1)染料(对硝基苯偶氮苯二酚)。若出现沉淀并吸附镁试剂(I)染料呈天蓝色,表示待测液中含有Mg2+。(注:Ag+、Cu2+、Fe3+、NH4+会妨碍Mg2+的检测)?
(2)Mg(OH)2可溶于浓的氯化铵溶液,其他的常见不溶性碱难溶于氯化铵溶液。
【实验探究】
(1)甲同学进行了初步实验,实验步骤和实验现象如下,请填写下表:
(2)乙同学取甲同学第②组实验所得的溶液,加入2滴NaOH溶液及镁试剂(Ⅰ)染料,未见天蓝色物质。他得出合金中不含镁的结论,乙同学的结论?(选填“正确”或“错误”),你的理由是?。
(3)丙同学设计实验方案,确定焰火原料中的金属种类,实验记录如下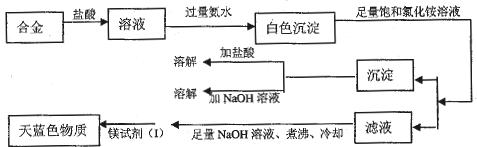
由丙同学的实验记录可知该焰火原料是由?和?两种金属组成的合金;
实验中滤液加入足量氢氧化钠溶液后需煮沸的理由?。
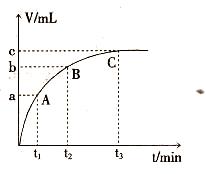
5、实验题 (8分)某学生为了探究锌与盐酸反应过程中的速率变化,他在100mL稀盐酸中加入足量的锌粉,用带刻度的集气瓶排水法收集氢气,每隔1分钟记录一次数据(累计值):
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |