时间:2020-07-07 23:16:10
1、实验题 (15分)
下面是中学化学中常用玻璃仪器组成的实验装置图(根据需要可在其中加入液体或固体)。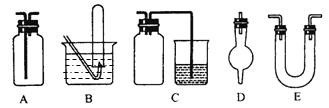
请回答下列问题:
⑴能用作干燥氨气的装置有___________(填字母);
⑵既能用于收集氯气又能用于收集一氧化氮气体的装置有____________(填字母);
⑶在氯气和铁反应实验中,能添加在制氯气和反应装置之间以除去氯气中氯化氢等杂质气体的装置有____________(填字母);
⑷能用于乙烯与溴水反应制二溴乙烷的实验装置有_____________(填字母);
⑸若用C装置作二氧化硫与烧杯中氢氧化钠溶液反应的实验,则其中广口瓶的作用是________________________________________________________________。
⑹为比较Fe3+和Cu2+对H2O2分解的催化效果,某同学设计了下图所示的实验。
①可通过观察?现象来定性比较得出
结论。
②有同学提出将CuSO4改为CuCl2更为合理,其理由是?;
你认为还可以作何改进?
?﹒
2、实验题 实验室中有一未知浓度的稀盐酸,某学生在实验室中进行测定盐酸的浓度的实验:请完成下列填空:(1)配制100 mL 0.10 mol/L NaOH标准溶液。
①配制所需的玻璃仪器有:烧杯、量筒、玻璃棒、?、?等。
②称量?g氢氧化钠固体所需仪器有:天平(带砝码、镊子)、药匙、?。
(2)取20.00 mL待测盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用?(填仪器名称)装配制的标准液NaOH溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。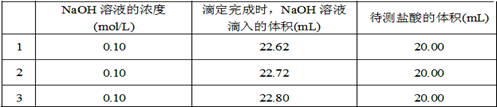
①滴定达到终点的标志是?。
②根据上述数据,可计算出该盐酸的浓度约为?(保留两位有效数字)。
③排去碱式滴定管中气泡的方法应采用如图所示操作中的?,然后轻轻挤压玻璃球使尖嘴部分充满碱液。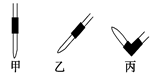
④在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有?。
A.滴定终点读数时俯视读数
B.碱式滴定管尖嘴部分有气泡,滴定后消失
C.锥形瓶水洗后未干燥
D.称量NaOH固体中混有Na2CO3固体
E. 酸式滴定管使用前,水洗后未用待测盐酸润洗
3、选择题 孔雀石的主要成分为xCuCO3·yCu(OH)2·zH2O,为测定其中CuCO3的质量分数,称取a g样品进行实验。下列实验方案可行的是
A.充分加热样品,用碱石灰吸收逸出气体,增重b g
B.加热至样品质量不再发生变化,称得其质量为b g
C.向样品中加入足量的稀盐酸,用排水法收集逸出气体,得b mL气体
D.向样品中加入足量的稀盐酸,充分反应,将生成的气体全部通入到足量Ba(OH)2溶液中,过滤、洗涤、烘干,得b g固体
4、选择题 下列叙述正确的是?
A.加入BaCl2溶液有白色沉淀产生,再加盐酸,沉淀不消失,原溶液一定有SO42—
B.滴入KMnO4酸性溶液,紫红色褪去,证明CH2=CHCH?2CHO中一定有碳碳不饱和键
C.某无色气体能使湿润的红色石蕊试纸变蓝,该气体的水溶液一定显碱性
D.加入稀盐酸,产生无色并能使澄清石灰水变浑浊的气体,原溶液一定有CO32—或SO32—
5、实验题 下面是某科学兴趣小组的同学做同周期元素性质递变规律实验时,设计的一套实验方案。其中实验步骤如下 
请整理并完成实验报告。
(1)实验目的:________。
(2)实验用品:试剂:金属钠,镁条,铝条,稀盐酸,新制氯水,新制Na2S溶液,AlCl3溶液,NaOH溶液等。仪器:①____,②______,表面皿,试管夹,镊子,小刀,玻璃片,砂纸等。
(3)实验内容:(完成下列表格中的实验现象和化学方程式,实验步骤略) 
(4)实验结论:________。
(5)请用原子结构的知识简单解释上述结论:_______________。