时间:2020-07-07 23:16:10
1、简答题 某研究性学习小组通过实验来探究乙二酸(又名草酸)受热分解的产物,他们设计的实验装置如图所示: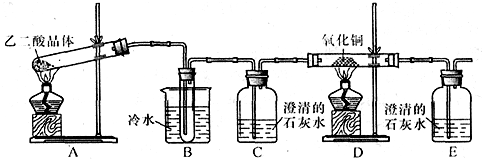
查阅资料可知:乙二酸晶体(H2C2O4?2H2O)熔点100.1℃,草酸钙是难溶于水的白色固体;Cu2O能溶于稀硫酸,立即发生歧化反应生成Cu2+和Cu.
(1)实验过程中观察到C、E装置中的溶液均变浑浊,且D装置中黑色粉末变为红色,写出A中发生反应的化学方程式:______;
(2)装置B的作用是______;上述装置中有两处需要改进(假设洗气装置每次吸收气体均完全),改进方法是______;______.
(3)实验结束后向装置B的试管中加入NaHCO3溶液,产生大量无色气体,由此可以证明两种物质的酸性强弱顺序是______.
(4)有人认为D装置中得到的红色固体可能是Cu,也可能是Cu和Cu2O的混合物.实验小组进一步探究:①取少量红色固体加入到盛稀硫酸的试管中,充分振荡,溶液变为蓝色,试管底部仍有红色固体,由此可以得出的结论是______.②取6.8g红色固体与足量的稀硝酸反应,收集到标准状况下的NO气体1.12L.则红色固体中含单质铜的质量分数是______.
参考答案:(1)C、E装置中的溶液均变浑浊,且D装置中黑色粉末变为红色,说明乙二酸晶体加热生成一氧化碳、二氧化碳和水,反应的化学方程式:H2C2O4?2H2O?△?.?CO↑+CO2↑+3H2O;
故答案为:H2C2O4?2H2O?△?.?CO↑+CO2↑+3H2O;
(2)乙二酸可以和氢氧化钙发生反应,所以防止对检验分解产物CO2的干扰,要除去生成物中带出的乙二酸蒸汽,一氧化碳在还原氧化铜之前要将气体干燥,一氧化碳有毒,所以要进行尾气处理,
故答案为:除去生成物中带出的乙二酸蒸汽,防止对检验分解产物CO2的干扰;在C与D之间再装配一个盛浓硫酸的洗气瓶(或装有碱石灰的干燥管),将装置E中出来的气体引到酒精灯火焰上让其燃烧(或收集装置E中逸出的尾气);
(3)B的试管中是乙二酸,加入NaHCO3溶液,产生大量无色气体应该是二氧化碳,化学反应遵循强酸制弱酸的原理,所以酸性是乙二酸大于碳酸(或H2C2O4>H2CO3),故答案为:乙二酸大于碳酸(或H2C2O4>H2CO3);
(4)①金属铜和硫酸不反应,但是氧化亚铜可以和硫酸反应生成金属铜和硫酸铜,根据实验现象:溶液变为蓝色,则证明红色固体中含有Cu2O,故答案为:红色固体中含有Cu2O;
②设红色固体中氧化亚铜的物质的量是x,金属铜的物质的量为y,根据质量关系得:144x+64y=6.8,根据电子守恒,得出:2x+2y=1.12L22.4L/mol×(5-2),两式联立解得x=0.025mol,y=0.05mol,所以Cu的质量分数为:0.05mol×64g/mol6.8g×100%=50%,故答案为:50%.
本题解析:
本题难度:一般
2、选择题 以下实验能获得成功的是
A.用醋酸钠晶体和碱石灰共热制甲烷
B.将铁屑、溴水、苯混合制溴苯
C.在苯酚溶液中滴人少量稀溴水出现白色沉淀
D.将铜丝在酒精灯上加热后,立即伸人无水乙醇中,铜丝恢复成原来的红色
参考答案:D
本题解析:A.应该用无水醋酸钠来制取甲烷
B.不能用溴水,应用液溴
C.保证溴水过量才可以
D.正确
本题难度:一般
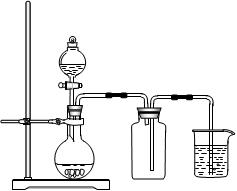
3、选择题 下列制备和收集气体的实验装置合理的是 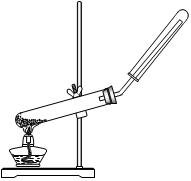
A.用氯化铵和氢氧化钙制NH3
B.用铜片和稀硝酸制NO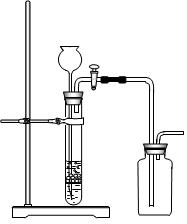
C.用锌粒和稀硫酸制H2
D.用双氧水和二氧化锰制O2
参考答案:D
本题解析:A中的发生装置大试管口要略向下倾斜;NO不能用排空气法收集,它易和氧气反应;氢气要用向下排空气法收集;密度小于空气密度;故选D。
点评:熟悉常见的气体制备和收集方法,此类问题便不难解决。
常见的气体制备和收集方法
氢气:活泼金属与稀酸,向下排空气法
氧气:加热氯酸钾+二氧化锰固体,排水法或者向上排空气法。
氮气:空气通过灼热的铜粉除氧气,然后通入氢氧化钠除二氧化碳,然后用浓硫酸干燥,排水法。
氯气:浓盐酸+高锰酸钾,向上排空气法,排水法(饱和氯化钠溶液)。
二氧化碳:碳酸钙和稀盐酸,向上排空气法。
氯化氢:浓硫酸加氯化钠加热,向上排空气法。
二氧化硫:亚硫酸钠加稀硫酸,向上排空气法,排水法(饱和亚硫酸钠溶液)。
一氧化氮,二氧化氮排水法收集就可以。
二氧化氮:浓硝酸加铜,向上排气法。
氨气:氢氧化钙加氯化铵,加热,向下排空气。
一氧化碳:二氧化碳通过灼热的碳。
甲烷:无水醋酸钠和碱石灰加热,排水法。
本题难度:简单
4、选择题 下列实验方法不能达到目的的是?(?)
A.用加热的方法分离氯化钠和氯化铵的固体混和物
B.用水鉴别乙醛、苯、硝基苯
C.用核磁共振氢谱鉴定未知物C2H6O的分子结构
D.用10mL量筒量取5.00mL1.00 mol·L-1盐酸配制0.100mol·L-1盐酸
参考答案:D
本题解析:略
本题难度:简单
5、实验题 酸碱中和滴定常用于测定酸碱溶液的浓度。
(1)实践中,在正式测定前,常常用已知浓度的酸(或碱)滴定已知浓度的碱(或酸),测定滴定曲线,然后选择合适的指示剂指示滴定终点,以保证数据的准确性。如:用0.100 0 mol/L NaOH溶液滴定20.00 mL 0.100 0 mol/L醋酸(CH3COOH) 溶液,有关数据记录如下表:
| V/(NaOH)/mL | 0.00 | 10.00 | 18.00 | 19.80 | 19.98 | 20.00 | 20.02 | 20.20 | 22.00 | 40.00 |
| 溶液pH | 2.87 | 4.74 | 5.70 | 6.74 | 7.74 | 8.72 | 9.70 | 10.70 | 11.70 | 12.50 |

参考答案:①略
②7.74~9.70 ③C 无色变为浅红色,且半分钟内颜色不再发生变化?
(2)锥形瓶内溶液颜色的变化
本题解析:略
本题难度:简单