时间:2020-07-07 23:14:04
1、选择题 甲、乙、丙为第二、三周期的元素,原子序数依次增大,甲和乙同周期,甲和丙同族,甲、乙原子序数之和与丙的原子序数相等,甲、丙原子的最外层电子数之和与乙原子的电子总数相等.下列说法中,不正确的是( )
A.乙是地壳中含量最多的元素
B.丙的氢化物比甲的氢化物热稳定性弱
C.乙与丙形成的化合物可制作光导纤维
D.甲、乙两种元素形成的化合物一定是离子化合物
2、选择题 短周期Y元素的p轨道上有3个未成对电子,则该元素的最高价氧化物的水化物的化学式可能是
[? ]
A.H3YO4
B.H4YO4
C.HYO2
D.H2YO4
3、填空题 A、B、C、D四种短周期元素,A、B、C同周期,A的原子半径是同周期中最大的;B、D同主族.己知D元素的一种单质是日常生活中饮水机常用的消毒剂,C元素的单质可以从A、B两元素组成的化合物的水溶液中置换出B元素的单质.
(1)C元素在周期表中的位置______.
(2)A元素与水反应的离子方程式是______.
(3)写出C元素的单质从A、B两元素组成的化合物的水溶液中置换出B元素的单质的化学方程式______.
(4)BD2和C2均具有漂白性,二者的漂白原理______.(填“相同”或“不同”)
(5)氢气是合成氨的重要原料,合成氨反应的热化学方程式如下:3H2+N2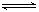
?2NH3△H=-92.4kJ?mol-1
①当合成氨反应达到平衡后,改变某一外界条件?(不改变N2、H2和NH3的量),反应速率与时间的关系如图所示.图中t1时引起平衡移动的条件可能是______,其中表示平衡混合物中NH3的含量最高的一段时间是______.
②温度为T℃时,将2a?molH2和a?molN2放入0.5L?密闭容器中,充分反应后测得N2的转化率为50%.则该反应的平衡常数为______.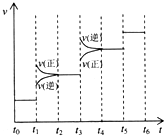
4、选择题 X、Y、Z、W、R属于短周期主旋元素.X的原子半径在短周期主旋元素中最大,Y元素的原子外层电子数为m,次外层电子数为n,Z元素的原子L层电子数为m+n,M层电子数为m-n,W元素与Z元素同主族,R元素原子与Y元素原子的核外电子数之比为2:1,下列叙述错误的是( )
A.X与Y形成的两种化合物中阴、阳离子的个数比均为1:2
B.Y的氢化物比R的氢化物稳定,沸点高
C.Z、W、R最高价氧化物对应水化物的酸性强顺序是:R>W>Z
D.WR2中既含有离子键又含有共价键
5、选择题 有X、Y两种元素,原子序数≤20,X的原子半径小于Y,且X、Y原子的最外层电子数相同(选项中m、n均为正整数),下列说法正确的是( )
A.若X(OH)n为强碱,则Y(OH)n也一定为强碱
B.若HnXOm为强酸,则X的氢化物溶于水一定显酸性
C.若X形成的单质是X2,则Y元素形成的单质一定是Y2
D.若Y的最高正价为+m,则X的最高正价一定为+m