时间:2020-07-07 22:54:59
1、填空题 (18分)某化学兴趣小组同学展开对漂白剂亚氯酸钠(NaClO2)的研究。
实验I:制取NaClO2晶体
己知:NaClO2饱和溶液在温度低于38℃时析出品体是NaClO2·3H2O,高于38℃时析出晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。利用下图所示装置进行实验。
(1)装置③的作用是 装置①的作用是
(2)装置②中制备ClO2的化学方程式为 ;产生ClO2的还原剂是装置④中制备NaClO2的化学方程式为
(3)从装置④反应后的溶液获得NaClO2晶体的操作步骤为:
①减压,55℃蒸发结晶:②趁热过滤;③ ;④低于60℃干燥,得到成品。
实验Ⅱ:测定某亚氯酸钠样品的纯度。
设计如下实验方案,并进行实验:①准确称取所得亚氯酸钠样品mg于小烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(已知:ClO2-+4I-+4H+=2H2O+2I2+Cl-)。将所得混合液配成250mL待测溶液。
②移取25.00mL待测溶液于锥形瓶中,加几滴淀粉溶液,用c mol·L-1 Na2S2O3标准液滴定,至滴定终点。重复2次,测得平均值为V mL(已知:I2+2S2O32-=2I-+S4O62-)。
(4)达到滴定终点时的现象为
(5)该样品中NaClO2的质量分数为 (用含m、c、V的代数式表示)。
(6)在滴定操作正确无误的情况下,此实验测得结果 (填“偏高”或“偏低”),原因用离子方程式表示为 。
参考答案:(1)防止倒吸;吸收装置中未反应的ClO2 ,防止外逸污染空气;
(2)Na2SO3+2NaClO3+H2SO4= 2Na2SO4+ 2ClO2↑+H2O; Na2SO3;
2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2↑(2分) ;
(3)用38 ℃~60 ℃的温水洗涤;(4)溶液由蓝色变为无色且半分钟不变色
(5)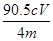 % 或 22.6Cv/m% (2分),(6)偏高 4I-+O2+4H+=2I2+2H2O (2分)
% 或 22.6Cv/m% (2分),(6)偏高 4I-+O2+4H+=2I2+2H2O (2分)
本题解析:(1)在装置②中发生反应制取ClO2,在装置④中气体进行反应,使装置内压强降低,装置③防止倒吸现象的发生;装置①中含有NaOH溶液,可以与ClO2,发生反应,因此其作用是吸收装置中未反应的ClO2 ,防止外逸污染空气;(2)在装置②中发生反应制取ClO2,根据电子守恒和质量守恒定律可得:Na2SO3+2NaClO3+H2SO4= 2Na2SO4+ 2ClO2↑+H2O。在该反应中Na2SO3中的S元素的化合价升高,失去电子,作还原剂;在装置④ClO2与NaOH的H2O2溶液发生氧化还原反应,产生反应后的溶液获得NaClO2晶体,在该反应中Cl元素的化合价降低,双氧水应表现还原性,有氧气生成,根据电子守恒、原子守恒可得方程式为: 2NaOH+ 2ClO2+ H2O2= 2NaClO2+2H2O+O2,(3)从溶液中制取晶体,一般采用蒸发结晶、过滤、洗涤、干燥的方法,为防止析出晶体NaClO2·3H2O,应趁热过滤,由题目信息可知,应该控制温度38℃~60℃进行洗涤,低于60℃干燥;(4)碘单质遇淀粉变蓝色,反应结束时,碘反应完全,所以滴加最后一滴Na2S2O3标准液时,溶液由蓝色变为无色且半分钟内不变色,说明到达滴定终点;(5)令样品中NaClO2的质量分数为a,根据反应方程式:ClO2-+4I-+4H+=2H2O+2I2+Cl-;I2+2S2O32-=2I-+S4O62-可得关系式:NaClO2~2I2~4S2O32-。则NaClO2与S2O32-的关系是每90.5g NaClO2对应消耗 4mol 的S2O32-。n(S2O32-)=" c" mol·L-1×V×10-3L×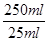 ,则m(NaClO2)=
,则m(NaClO2)=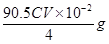 。所以NaClO2的纯度是a= [m(NaClO2)÷m(总)]×100=
。所以NaClO2的纯度是a= [m(NaClO2)÷m(总)]×100=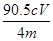 %=22.6Cv/m%。(6)(6)在滴定操作正确无误的情况下,由于反应过程会产生氧气,氧气会将溶液中的I-氧化为I2单质,使溶液中碘的含量偏高,滴定消耗的Na2S2O3标准液体积偏高,故会使实验测得结果偏高。反应离子方程式为4I-+O2+4H+=2I2+2H2O。
%=22.6Cv/m%。(6)(6)在滴定操作正确无误的情况下,由于反应过程会产生氧气,氧气会将溶液中的I-氧化为I2单质,使溶液中碘的含量偏高,滴定消耗的Na2S2O3标准液体积偏高,故会使实验测得结果偏高。反应离子方程式为4I-+O2+4H+=2I2+2H2O。
考点:考查物质制取过程中装置的作用、物质制取原理的方程式表示、滴定终点的判断、误差分析、关系式法在物质纯度的计算中的作用的知识。
本题难度:一般
2、填空题 (4分)今有①CH3COOH;②HCl;③H2SO4三种溶液,选择填空:
A.①>②>③
B.①<②<③
C.①=②=③
D.①=③>②
E.①>②=③ F.①<②=③ G.①=②<③ H.①=②>③
(1)当它们pH相同时,其物质的量浓度关系是 。
(2)体积和物质的量浓度相同的①、②、③三溶液,分别与同浓度的烧碱溶液反应,要使反应后的溶液呈中性,所需烧碱溶液的体积关系为 。
(3)当它们pH相同、体积相同时,分别加入足量锌,相同状况下产生气体体积关系为 。
(4)将pH相同的三种酸均稀释10倍后,pH关系为 。
参考答案:A、B、E、F
本题解析:(1)当溶液中氢离子浓度相同,假设提供1mol/L的氢离子,需要醋酸浓度应大于1mol/L,需要盐酸溶液浓度为1mol/L,H2SO4溶液浓度为0.5mol/L,所以其物质的量浓度由大到小排列的是:①>②>③;(2)体积和浓度相同的①、②、③三溶液,假设溶质为1mol,分别与同浓度的烧碱溶液反应,要使反应后溶液的pH为7,①CH3COOH是弱酸,恰好中和生成醋酸钠溶液呈碱性,所以需要烧碱小于1mol;②和1molH氢氧化钠恰好反应溶液呈中性;③1molH2SO4和2mol恰好反应需要氢氧化钠2mol; 所需烧碱溶液的体积由大到小关系为③>②>①;(3) pH相同即它们溶液中c(H+)相同、体积相同时,分别加入足量锌,氢元素的物质的量越多,生成氢气则越多,所以醋酸生成氢气最多,盐酸和硫酸生成氢气相同,所以气体体积大小顺序是:①>②=③;(4) 将溶液中c(H+)相同的三种酸均稀释10倍后,醋酸中存在电离平衡,所以加水稀释促进醋酸电离,硫酸和氯化氢都是强电解质,加水稀释改变氢离子个数,所以氢离子浓度相等,醋酸中氢离子浓度最大,则氢离子浓度大小顺序是①>②=③,pH关系为①<②=③。
考点:考查弱电解质在水溶液中的电离平衡。
本题难度:一般
3、选择题 将20mL0.4 mol·L-1硝酸铵溶液跟50mL 0.1 mol·L-1氢氧化钡溶液混合,则混合溶液中各离子浓度的大小顺序是
A.c(NO3-)> c(OH-)> c(NH4+) > c(Ba2+)
B.c(NO3-) > c(Ba2+) > c(OH-) > c(NH4+)
C.c(Ba2+) > c(NO3-) > c(OH-) > c(NH4+)
D.c(NO3-) > c(Ba2+) > c(NH4+) > c(OH-)
参考答案:B
本题解析:分析:先计算硝酸铵和氢氧化钡的物质的量,再利用硝酸铵和氢氧化钡的反应来分析反应后所得溶液中各种离子的物质的量的多少.
解:20mL 0.4mol/L硝酸铵溶液中硝酸铵的物质的量为20mL×10-3L×0.4mol/L=0.008mol,
50mL 0.1mol/L氢氧化钡溶液中氢氧化钡的物质的量为50mL×10-3L×0.1mol/L=0.005mol,
硝酸铵和氢氧化钡混合以后发生反应:2NH4NO3+Ba(OH)2=Ba(NO3)2+2NH3?H2O,
则反应后,70ml溶液的组成为:剩余氢氧化钡0.001mol,生成的硝酸钡0.004mol,生成的一水合氨0.008mol,
在体积一样的前提下,物质的量越大,浓度越大,故c(NO3-)>c(Ba2+),
而氨水能电离出少量且相等的铵根和氢氧根,氢氧化钡中还有0.002mol的氢氧根,所以c(OH-)>c(NH4+),
故离子浓度大小顺序为:c(NO3-)>c(Ba2+)>c(OH-)>c(NH4+).
故选B.
点评:本题考查学生溶液混合以后离子浓度大小的比较问题,关键是找出反应以后溶液的组成以及各个离子的量的多少,是现在高考的热点和难点.
本题难度:一般
4、选择题 常温下,用 0.10 mol·L-1 NaOH溶液分别滴定20.00 mL 0.10 mol·L-1 HCl溶液和20.00 mL 0.10 mol·L-1 CH3COOH溶液,得到2条滴定曲线,如下图所示,则下列说法正确的是( )

图1 图2
A.图2是滴定盐酸的曲线
B.a与b的关系是:a<b
C.E点对应离子浓度由大到小的顺序为: c(CH3COO-)> c(Na+)> c(H+)> c(OH-)
D.这两次滴定都可以用甲基橙作为指示剂
参考答案:C
本题解析:A、图1中起始的pH对应的是1,因此图1是盐酸,那么图2一定是醋酸,错误;B、醋酸与氢氧化钠反应生成中性溶液时,碱的量是少一点的,因此a>b,错误;C、E点对应的点是显酸性的,结合电荷守恒,其离子浓度由大到小的顺序为: c(CH3COO-)> c(Na+)> c(H+)> c(OH-),正确;D、图2实验选用甲基橙不合适,因为刚好反应完全时,溶液显碱性,应选用酚酞作指示剂,错误。
考点:考查酸碱中和图像问题。
本题难度:困难
5、选择题 313 K时,水的KW=3.0×10-14,则在313 K时,c(H+)=10-7 mol/L的溶液( )
A.呈酸性
B.呈中性
C.呈碱性
D.无法判断
参考答案:C
本题解析:解答本题时应注意以下两点:
(1)判断溶液的酸碱性最根本的依据是溶液中c(H+)与c(OH-)的相对大小;
(2)根据水在一定温度下的KW可以通过计算确定溶液呈中性时的c(H+)。
本题难度:一般