时间:2020-07-07 22:53:14
1、选择题 常温下,用 0.1000 mol·L-1NaOH溶液滴定 20.00mL0.1000 mol·L-1某一元弱酸HA溶液滴定曲线如图。下列说法正确的是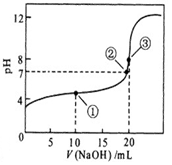
A. 点①所示溶液中:c(A-)+c(OH-) =c(HA) +c(H+)
B. 点②所示溶液中:c(Na+) = c(HA) +c(A-)
C. 点③所示溶液中:c(Na+) > c(A-)> c(OH-) > c(H+)
D. 滴定过程中可能出现:c(HA) > c(A-) > c(H+) > c(OH-)> c(Na+)
2、实验题 (12分)硫代硫酸钠(Na2S2O3·5H2O)俗名“大苏打”,又称为“海波”。它易溶于水,难溶于乙醇,加热易分解。工业上常用亚硫酸钠法、硫化碱法等制备。某实验室模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如下图:实验具体操作步骤为: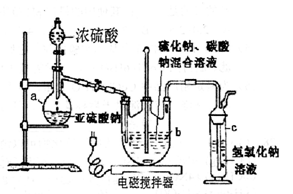
①开启分液漏斗,使硫酸慢慢滴下,适当调节螺旋夹,使反应产生的SO2气体较均匀地通入Na2S和Na2CO3的混合溶液中,同时开启电磁搅拌器搅动。
②至析出的硫不再消失,控制溶液的pH接近
7时,停止通入SO2气体。
③抽滤所得的滤液,转移至蒸发皿中,水浴加热
浓缩,直到溶液表面出现晶膜。
④冷却结晶、抽滤、洗涤。
⑤将晶体放入烘箱中,在40~45℃左右干燥
50~60min,称量。
请回答以下问题:
(l)仪器a的名称是?;
(2)步骤②中若控制pH值小于7,则产率会下降,请用离子方程式解释原因:?。
(3)步骤③中不能将溶液蒸发至干的原因是?;晶膜通常在溶液表面出现的原因是?。
(4)步骤④中洗涤硫代硫酸钠晶体所用试剂的结构式是?。
(5)为检验制得的产品的纯度,该实验小组称取5,0克的产品配制成250mL硫代硫酸钠溶液,并用间接碘量法标定该溶液的浓度:在锥形瓶中加入25mL 0.0lmol·L-1 KIO3溶液,并加入过量的KI并酸化,发生下列反应:5I-+IO3-+6H+=3I2+3H2O,再加入几滴淀粉溶液,立即用所配Na2S2O3溶液滴定,发生反应:I2+2S2O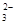 =2I-+S4O
=2I-+S4O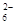 ,当蓝色褪去H半分钟不变色时到达滴定终点。实验数据如下表:
,当蓝色褪去H半分钟不变色时到达滴定终点。实验数据如下表:
| 实验序号 | 1 | 2 | 3 |
| Na2S2O3溶液体积(mL) | 19.98 | 20.02 | 21.18 |
3、实验题 氯化钙常用于道路融冰剂和干燥剂,具有易溶于水,易吸潮等性质。实验室用工业大理石(含有少量Al2O3、Fe2O3等杂质)制备氯化钙的主要流程如下: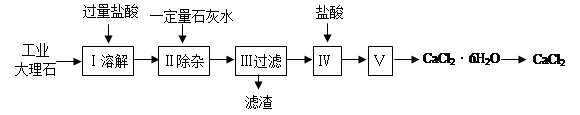 完成下列填空:
完成下列填空:
(1)上述使用的盐酸的物质的量浓度约为6.0mol/L,若用36.5%的盐酸(密度为1.2g/mL)配置6.0mol/L的盐酸100mL,所需的玻璃仪器有玻璃棒、量筒、胶头滴管、?;需要量取36.5%的盐酸?mL;配制过程中,若其他操作都正确,下列操作会引起浓度偏小的是?。
A.定容摇匀后发现液面低于刻度线
B.定容时俯视容量瓶的刻度线
C.将溶液转入容量瓶后,没有洗涤烧杯和玻璃棒,就转入定容操作
D.如果加水超过了刻度线,取出少量水使液面恰好到刻度线
(2)步骤Ⅰ中有关反应的离子方程式有:?、?、?。
(3)步骤Ⅱ控制石灰水用量的目的是防止(用离子方程式表示):?。
(4)滤渣的主要成分有(写化学式)?。
(5)步骤Ⅴ所含的操作依次是 ??、?。
(6)制得的氯化钙可以通过如下步骤测定其纯度:
①称取5.5g无水氯化钙样品;②溶解;③滴入足量Na2CO3溶液,充分反应后过滤;④?、?;⑤称量。若得到4.3g碳酸钙,则氯化钙的质量分数为 ?;若实验操作规范而测定结果偏低,其原因是 ?。
4、选择题 下述实验能达到预期目的的是
| ? | 实验内容 | 实验目的 |
| A | 向蔗糖溶液中加入4滴稀硫酸,煮沸几分钟、冷却,再加入银氨溶液,水浴加热 | 检验蔗糖是否已水解 |
| B | 将Cl2通入NaBr溶液中 | 比较氯气与溴的氧化性强弱 |
| C | 将铜与浓硝酸反应生成的气体收集后用冰水混合物冷却降温 | 研究温度对化学平衡的影响 |
| D | 分别向2支试管中加入相同体积不同浓度的H2O2溶液,再向其中1支加入少量MnO2 | 研究催化剂对H2O2分解速率的影响 |
5、选择题 下列有关实验操作正确的是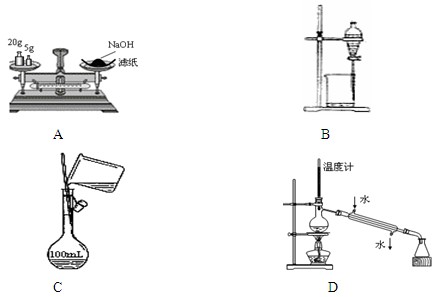
A.称量氢氧化钠固体
B.分离四氯化碳和水
C.配制150 mL 0.10 mol·L-1盐酸
D.分离两种沸点相差较大的液体互溶混合物