时间:2019-07-04 01:11:44
1、选择题 将一元酸溶液甲和一元碱溶液乙等体积混合后,溶液的pH<7,则下列叙述中可能的情况是
A.甲是弱酸,乙是强碱,混合后原酸碱恰好中和
B.甲是强酸,乙是强碱,混合前甲、乙的物质的量浓度相等
C.甲是强酸,乙是弱碱,混合前甲中C(H+)和乙中C(OH-)相等
D.甲是弱酸,乙是强碱,混合前甲中C(H+)和乙中C(OH-)相等
参考答案:D
本题解析:
本题难度:困难
2、选择题 常温下,稀释0.1 mol·L-1Na2CO3溶液,图中的纵坐标可以表示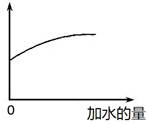
A.CO32-水解的平衡常数
B.溶液的pH
C.溶液中HCO3-的数目
D.溶液中的c(CO32-)
参考答案:C
本题解析:碳酸钠溶于水CO32-水解CO32-+H2O HCO3-+OH-,HCO3-+H2O
HCO3-+OH-,HCO3-+H2O H2CO3+OH-。稀释促进水解。根据图像可知,随着水的加入,纵坐标是增加的。A、水解平衡常数只与温度有关系,因此稀释过程中水解平衡常数不变,A不正确;B、稀释促进水解,溶液中OH-个数增加,但OH-浓度降低,因此溶液的pH减小,B不正确;C、稀释促进水解,HCO3-的浓度减小,但HCO3-个数增加,C正确;、稀释促进水解,c(CO32-)减小,D不正确,答案选C。
H2CO3+OH-。稀释促进水解。根据图像可知,随着水的加入,纵坐标是增加的。A、水解平衡常数只与温度有关系,因此稀释过程中水解平衡常数不变,A不正确;B、稀释促进水解,溶液中OH-个数增加,但OH-浓度降低,因此溶液的pH减小,B不正确;C、稀释促进水解,HCO3-的浓度减小,但HCO3-个数增加,C正确;、稀释促进水解,c(CO32-)减小,D不正确,答案选C。
考点:考查稀释对碳酸钠水解平衡的影响以及离子浓度变化判断
本题难度:一般
3、填空题 (Ⅰ)常温下,将某一元酸HA(甲、乙、丙、丁代表不同的一元酸)和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合溶液的pH如下表所示:
| 实验 编号 | HA的物质的量浓度(mol·L-1) | NaOH的物质的量浓度(mol·L-1) | 混合后溶液的pH |
| 甲 | 0.1 | 0.1 | pH=a |
| 乙 | 0.12 | 0.1 | pH=7 |
| 丙 | 0.2 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=10 |
 H++B2-
H++B2-参考答案:(1)a=7时,HA是强酸;a>7时,HA是弱酸
(2)C
(3)c(Na+)>c(A-)>c(OH-)>c(H+)
(4)10-4-10-10
(5)A、C
本题解析:(1)一元酸HA与NaOH等物质的量反应,酸性强弱取决于完全中和后盐的pH,a=7为强酸,a>7为弱酸;
(2)根据电荷守恒,有c(Na+)+c(H+)=c(A-)+c(OH-),因c(H+)=c(OH-),所以c(Na+)=c(A-);
(3)丙为等浓度的HA与NaA的混合溶液,由pH>7知A-水解程度大于HA的电离,离子浓度大小关系为c(Na+)>c(A-)>c(OH-)>c(H+);
(4)据电荷守恒c(Na+)+c(H+)=c(A-)+c(OH-),推导c(Na+)-c(A-)=c(OH-)-c(H+)=10-4-10-10;
(5)注意题干中的电离方程式,判断A项为B元素的物料守恒,C项为溶液中的质子守恒。
本题难度:困难
4、选择题 在
 溶液中,下列关系中不正确的是
溶液中,下列关系中不正确的是
A.
B.
C. -c(CO32-)
-c(CO32-)
D.
参考答案:A
本题解析:略
本题难度:一般
5、填空题 现有浓度均为0.1mol·L-1的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸氢铵、⑦氨水,请回答下列问题:
(1)①、②、③、④四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号)____________。
(2)④、⑤、⑥、⑦四种溶液中 浓度由大到小的顺序是(填序号)________。
浓度由大到小的顺序是(填序号)________。
(3)将③和④按体积比1
参考答案:
本题解析:
本题难度:一般