时间:2019-07-04 01:11:44
1、选择题 下列各物质中,不能发生水解反应的是( )
A.纤维素
B.蛋白质
C.油脂
D.葡萄糖
参考答案:D
本题解析:
本题难度:简单
2、选择题 下列判断中,正确的是
A.已知25 ℃时NH4CN显碱性,则25 ℃时的电离常数K(NH3·H2O)>K(HCN)
B.25 ℃时,Mg(OH)2固体在20 mL0.01 mol·L-1氨水中的Ksp比在20 mL0.01 mol·L-1 NH4Cl溶液中的Ksp小
C.pH试纸测得新制氯水的pH为4
D.FeCl3溶液和Fe2(SO4)3溶液加热蒸干.灼烧都得到Fe2O3
参考答案:A
本题解析:已知25 ℃时NH4CN显碱性,说明CN-的水解能力大于NH4+的水解,NH3·H2O电离大于HCN,电离程度越大,电离常数越大,正确;B、Ksp只受温度影响,温度不变,Ksp不变,错误;C、新制氯水中有HCl、HClO,HCl是pH变色,但是HClO具有强氧化性,把有色物质漂白,因此pH试纸不能读出新制氯水的pH,错误;D、FeCl3溶液加热蒸干灼烧得到Fe2O3,Fe2(SO4)3溶液加热蒸干,灼烧得到Fe2(SO4)3,错误。
考点:考查弱电解质的电离平衡常数、Ksp、盐类水解等相关内容。
本题难度:一般
3、填空题 (7分)NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,
用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛.请回答下列问题: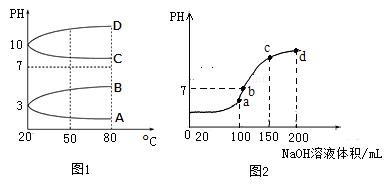
(1)相同条件下,相等物质的量浓度的NH4Al(SO4)2中c(NH4+) (填“=”、“>”“<”)NH4HSO4中c(NH4+)。
(2)如图1是0.1mol?L
参考答案:
本题解析:
本题难度:困难
4、选择题 在Na2S溶液中,下列关系不正确的是
A.c(Na+)=2c(HS—)+2c(S2—)+c(H2S)
B.c(Na+)+c(H+)=c(OH—)+c(HS—)+2c(S2—)
C.c(Na+)>c(S2—)>c(OH>c(HS—)
D.c(OH—)=c(HS—)+c(H+)+2c(H2S)
参考答案:A
本题解析:Na2S溶液中存在的三种守恒,电荷守恒守恒:c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-),物料守恒:2c(S2-)+2c(HS-)+2c(H2S)=c(Na+);质子守恒:c(H+)+2c(H2S)+c(HS-)=c(OH-),A、根据物料守恒,c(H2S)前面缺少2,错误;B、是电荷守恒,正确;C、Na2S是强碱弱酸盐,S2-水解的反应方程式:S2-+H2O HS-+OH-,HS-+H2O
HS-+OH-,HS-+H2O H2S+OH-,水解程度非常微弱,多元弱酸根的水解第一步为主,离子浓度大小顺序:c(Na+)>c(S2—)>c(OH>c(HS—),正确;D、是质子守恒,正确。符合题意的是A选项。
H2S+OH-,水解程度非常微弱,多元弱酸根的水解第一步为主,离子浓度大小顺序:c(Na+)>c(S2—)>c(OH>c(HS—),正确;D、是质子守恒,正确。符合题意的是A选项。
考点:考查三个守恒及离子浓度大小。
本题难度:一般
5、选择题 常温下,对pH=10的NaHCO3溶液中,各微粒的物质的量浓度分析正确的是
A.c(CO32—)>c(H2CO3)
B.c(Na+)>c(HCO3—)>c(OH―)>c(H+)
C.c(Na+)+c(H+)=c(HCO3—)+c(CO32—)+c(OH―)
D.c(Na+)=c(HCO3—)+c(CO32—)+c(H2CO3)
参考答案:BD
本题解析:试题分析:A、HCO3—水解生成H2CO3和OH—,HCO3—电离生成CO32—和H+,由于pH=10,说明水解程度大于电离,错误;B、水解、电离都是微弱的,正确;C、根据电荷守恒式,应为c(Na+)+c(H+)=c(HCO3—)+2c(CO32—)+c(OH―),错误;D、由物料守恒式,n(Na):n(C)=1:1,正确。
考点:考查电解质溶液中的守恒式及离子浓度大小比较。
本题难度:一般