时间:2019-07-04 01:02:13
1、选择题 关于强、弱电解质的有关叙述错误的是( )
A.强电解质在水溶液中完全电离成阴、阳离子
B.在溶液中,导电能力强的电解质是强电解质
C.对同一弱电解质来说,当溶液的温度和浓度不同时,其导电能力也不相同
D.纯净的强电解质在液态时,有的导电,有的不导电
参考答案:B
本题解析:判断强弱电解质就是看电解质在水溶液中是否完全电离。B项导电能力强只能说明溶液中离子浓度大,并不能说明溶质是完全电离的。D项是正确的,因为有些强电解质是共价化合物,在液态时没有自由移动的离子,所以不导电。
本题难度:一般
2、选择题 25 ℃时,浓度均为0.2 mol/L的NaHCO3和Na2CO3溶液中,下列判断不正确的是
[? ]
A.均存在电离平衡和水解平衡
B.存在的粒子种类相同
C.c(OH-)前者大于后者
D.分别加入NaOH固体,恢复到原温度,c(CO32-)均增大
参考答案:C
本题解析:
本题难度:一般
3、填空题 浓度均为0.1mol/L的8种溶液① HNO3 ② H2SO4 ③ CH3COOH ④ Ba(OH)2 ⑤ NaOH ⑥ CH3COONa
⑦ KCl ⑧ NH4Cl,溶液PH由大到小的顺序是_________(填写编号)
参考答案:④⑤⑥⑦⑧③①②
本题解析:
本题难度:一般
4、填空题 (12分)⑴① NH3?②SO3?③Cl2?④BaSO4?⑤酒精?⑥CH3COONH4?⑦HClO ⑧Cu。
以上物质中属于非电解质的是? ?,属于强电解质的是? ?。
⑵常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示。则图中表示醋酸溶液中pH变化曲线的是? (填“A”或“B”),设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为m2。则m1?m2(填“<”、“=”、“>”)。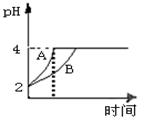
⑶在25℃时,有pH为a(a≤6)的盐酸和pH为b(b≥8)的NaOH溶液,取Va L该盐酸,与该NaOH溶液中和,需Vb LNaOH溶液。若a + b>15,则Va∶Vb = ? ?(填表达式),且Va Vb(填“>”“<”或“=”)
参考答案:⑴①②⑤;④⑥。?⑵B;<?⑶Va/Vb=1×10a+b-14;?>
本题解析:(1)溶于水和熔融状态下均不能导电的化合物是非电解质,所以答案是①②⑤。在溶液中能完全电离的电解质是强电解质,因此答案是④⑥。
(2)醋酸是弱电解质,存在电离平衡。在醋酸和锌的反应过程中,醋酸会继续电离出氢离子,所以在pH相等的条件下,醋酸溶液的pH变化程度小,因此B表示的是醋酸。由于在反应过程中醋酸会继续电离出氢离子,所以在pH变化相同的条件下,醋酸消耗的锌要多。
(3)如果盐酸的物质的量大于氢氧化钠的,则盐酸过量,溶液显酸性,反之显碱性。相等则显中性。若二者恰好完全反应时,则Va×10-a=Vb×1×10—14÷10—b,解得Va/Vb=1×10a+b-14。若a + b>15,则Va/Vb>10。
本题难度:一般
5、选择题 在CH3COOH?H++CH3COO-的电离平衡中,要使电离平衡向逆反应方向移动,不应采取的措施是( )
A.加H2SO4
B.加NaOH固体
C.加CH3COONa
D.加盐酸
参考答案:A.向醋酸中加入硫酸,溶液中氢离子浓度增大,抑制醋酸电离,平衡向逆反应方向移动,故A不选;
B.向溶液中加入固体氢氧化钠,氢氧根离子和氢离子反应生成水,所以能促进醋酸电离,平衡向正反应方向移动,故B选;
C.向醋酸中加入醋酸钠固体,醋酸钠中含有醋酸根离子,所以溶液中醋酸根离子浓度增大,抑制醋酸电离,平衡向逆反应方向移动,故C不选;
D.向溶液中加入盐酸,溶液中氢离子浓度增大,抑制醋酸电离,平衡向逆反应方向移动,故D不选;
故选B.
本题解析:
本题难度:一般