时间:2019-07-04 00:59:22
1、填空题 (10分)磺酰氯(SO2Cl2)是一种有机氯化剂,也是锂电池正极活性物质。已知磺酰氯是一种无色液体,熔点-54.1℃,沸点69.1℃,遇水发生剧烈水解。
(1)磺酰氯可与白磷发生反应为:P4+ 10SO2Cl2= 4PCl5 + 10SO2↑,若生成1molSO2,则转移电子的物质的量为 mol。
(2)某学习小组的同学依据反应:SO2(g)+ Cl2(g) SO2Cl2(g) △H <0,设计的制备磺酰氯装置如图甲。
SO2Cl2(g) △H <0,设计的制备磺酰氯装置如图甲。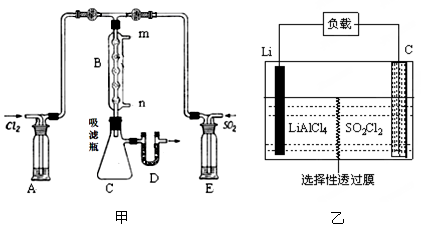
①若用浓盐酸与二氧化锰为原料制取Cl2,其反应的化学方程式为 。
②有关题图甲所示的装置说法正确的是 (不定项选择)。
a.A、E处洗气瓶中盛放的可能分别是饱和食盐水和饱和Na2SO3溶液
b.D处U形管中盛放的可以是碱石灰
c.B处反应管冷却水应从m接口通入
d.装置C处吸滤瓶若放在冰水中冷却,更有利于SO2Cl2的收集
③从化学平衡移动角度分析,反应管通水冷却的目的为 。
(3)GET公司开发的Li-SO2Cl2军用电池,其示意图如图乙所示,已知电池反应为:2Li + SO2Cl2 =" 2LiCl" + SO2↑,则电池工作时,正极的电极反应式为 。
参考答案:(10分,每空2分)(1)2 (2)①MnO2 + 4HCl(浓)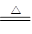 MnCl2 + Cl2 ↑+ 2H2O
MnCl2 + Cl2 ↑+ 2H2O
②bd (答对一个得1分,有错无分)
③冷凝SO2Cl2、降温均使平衡右移,有利于SO2Cl2生成(意思对即给分,对一项即给2分)
(3)SO2Cl2 + 2e-=2Cl- + SO2↑
本题解析:(1)根据方程式可知 P元素化合价从0价升高到+5价,失去5个电子。S元素化合价从+6价降低到+4价,所以若生成1molSO2,转移电子的物质的量为2mol。
①浓盐酸与二氧化锰为原料制取Cl2,反应的化学方程式为MnO2 + 4HCl(浓)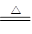 MnCl2 + Cl2 ↑+ 2H2O。
MnCl2 + Cl2 ↑+ 2H2O。
②a.生成的氯气中含有氯化氢,可以用饱和食盐水除杂,但亚硫酸钠能吸收SO2,所以E处洗气瓶中不能盛放饱和Na2SO3溶液,应该用浓硫酸,a错误;b.磺酰氯是一种无色液体,熔点-54.1℃,沸点69.1℃,遇水发生剧烈水解,所以应该防止空气中的水蒸气进入C中,则D处U形管中盛放的可以是碱石灰,b正确;c.B处反应管冷却水应从n接口通入,C错误;d.由于磺酰氯的熔点-54.1℃,沸点69.1℃,所以装置C处吸滤瓶若放在冰水中冷却,更有利于SO2Cl2的收集,d正确,答案选bd。
③由于正方应是放热反应,则反应管通水冷却可以冷凝SO2Cl2、降温均使平衡右移,有利于SO2Cl2生成。
(3)原电池中正极得到电子,则根据方程式可知正极是SO2Cl2得到电子,电极反应式为SO2Cl2 + 2e-=2Cl- + SO2↑。
考点:考查物质制备实验方案设计与探究
本题难度:困难
2、选择题 右图为某原电池的装置,下列有关该原电池的说法中正确的是( )
A.铁棒为正极
B.铜棒上发生还原反应
C.铁棒质量增加
D.电流从铁棒经外电路流向铜棒
参考答案:A.铁比铜活泼,应为原电池的负极,故A错误;
B.铜为正极,正极发生还原反应,故B正确;
C.铁为负极,被氧化,质量减小,故C错误;
D.电流由铜棒经外电路流向铁棒,故D错误.
故选B.
本题解析:
本题难度:简单
3、选择题 如图:X为单质硅,Y为金属铁,a为NaOH溶液,按图组装一个原电池,下列说法正确的是( )
A.X为负极,电极反应为:Si-4e-═Si4+
B.X为正极,电极反应为:4H2O+4e-═4OH-+2H2↑
C.X为负极,电极反应为:Si+6OH--4e-═SiO32-+3H2O
D.Y为负极,电极反应为:Fe-2e-═Fe2+
参考答案:硅易失电子发生氧化反应而作负极,电极反应式为Si+6OH--4e-═SiO32-+3H2O,铁作正极,正极上水得电子发生还原反应,电极反应式为4H2O+4e-═4OH-+2H2↑,
故选:C.
本题解析:
本题难度:一般
4、填空题 (1)如图所示,A为电源,B为浸透饱和食盐水和酚酞试液的滤纸,滤纸中央滴有一滴KMnO4溶液,C、D为电解槽,其电极材料见图,电解质溶液:C装置中溶液为AgNO3溶液,D装置的溶液为Cu(NO3)2溶液,.关闭K1,打开K2,通电后,B的KMnO4紫红色液滴向d端移动,则电源a端为______极,通电一段时间后,观察到滤纸c端出现的现象是:______;
(2)打开K1,关闭K2,通电一段时间后,D装置中Cu极的电极反应式为
______.
C装置中右端Pt电极上的电极反应式为:______.
C装置中总反应方程式为:______.
(3)假定C、D装置中电解质溶液足量,电解一段时间后,C装置中溶液的pH值______(填“变大”、“变小”或“不变”,下同),D装置中溶液的pH值______.
参考答案:(1)据题意KMnO4紫红色液滴向d端移动,说明高锰酸根离子向d端移动,可推出极为阳极,进一步可确定电源a端为负极,b端为正极,通电一段时间后,滤纸c端发生反应为2H++2e-=H2↑,促进水的电离,滴加酚酞呈红色,
故答案为:负;变红色;
(2)打开K1,关闭K2,为电解硝酸银和硝酸铜的串联电路,D装置中Cu极连接电源的正极,为电解池的阳极,发生氧化反应,电极方程式为Cu-2e-=Cu2+,
C装置中右端Pt电极为阳极,氢氧根离子放电生成氧气,电解方程式为4OH--4e-=2H2O+O2↑,电解总反应为4AgNO3+2H2O?电解?.?4Ag+O2↑+4HNO3 ,
故答案为:Cu-2e-=Cu2+;?4OH--4e-=2H2O+O2↑;4AgNO3+2H2O?电解?.?4Ag+O2↑+4HNO3 ;
(3)C装置中总反应方程式为4AgNO3+2H2O?电解?.?4Ag+O2↑+4HNO3 ,溶液pH减小,D为电镀装置,溶液浓度不变,则pH不变,故答案为:减小;不变.
本题解析:
本题难度:一般
5、简答题 利用碳棒、锌片和200ml稀硫酸组成原电池,将化学能转化为电能,当碳棒上共产生3.36L(标准状况)气体时,硫酸恰好全部被消耗.试计算:
(1)有多少个电子通过了导线.
(2)原稀硫酸溶液的物质的量浓度.
参考答案:(1)Zn+H2SO4 =ZnSO4 +H2↑? ?转移电子
? 22.4L?2×6.02×1023个?
? 3.36L? 1.806×1023个?
故答案为:1.806×1023个.
(2)Zn+H2SO4 =ZnSO4 +H2↑?
? ?1mol? 22.4L?
?0.15mol? 3.36L?
C=nV=0.15mol?0.2L=0.75mol/L
故答案为0.75mol/L
本题解析:
本题难度:一般