时间:2019-07-04 00:59:22
1、选择题 关于下列各装置图的叙述中,正确的是
A.装置①阳极有红色物质析出
B.装置②的总反应为Cu+2Fe3+=Cu2++2Fe2+
C.装置③中a为负极,发生的电极反应式为H2+2OH-—2e-=2H2O
D.用装置④精炼铜,则a极为纯铜,电解质溶液可为CuSO4溶液
参考答案:C
本题解析:A.装置①是电解池,阳极氢氧根失去电子,生成氯气,阴极铜离子放电,则阴极有红色物质析出,A错误;B.装置②是原电池,铁的金属性强于铜,铁是负极,总反应为Fe+2Fe3+=3Fe2+,B错误;C.装置③中氢气在负极通入,则a电极是 www.91exAm.org负极,发生的电极反应式为H2+2OH-—2e-=2H2O,C正确;D.用装置④根据电流方向可知装置④a电极是阳极,b为阴极。如果精炼铜,则b极为纯铜,a为粗铜,电解质溶液可为CuSO4溶液,D错误,答案选C。
考点:考查电化学原理的应用
本题难度:一般
2、选择题 关于原电池的下列说法中,正确的是
A.在正极上发生氧化反应
B.一般化学性质较活泼的金属为负极
C.在外电路上电子流出正极
D.是由电能转化为化学能的装置
参考答案:B
本题解析:负氧正还,所以正极发生还原反应,一般较活泼的金属失电子做负极,电子从负极流出,原电池是化学能转变成电能的装置。
本题难度:简单
3、填空题 (1)有人研究证明:使用氯气作自来水消毒剂,氯气会与水中有机物反应,生成如CHCl3等物质,这些物质可能是潜在的致癌致畸物质。目前人们已研发多种饮用水的新型消毒剂。下列物质不能作自来水消毒剂的是_________(填序号)。
A.硫酸铜 B.二氧化氯 C.臭氧 D.硫酸亚铁
(2)高铁(VI)酸盐(如Na2FeO4)是新一代水处理剂。其制备方法有:次氯酸盐氧化法(湿法)和高温过氧化物法(干法)等。湿法是在碱性溶液中用次氯酸盐氧化铁(III)盐,写出该法的离子方程式:
__________________。
(3)用高铁(VI)酸盐设计的高铁(VI)电池是一种新型可充电电池,电解质溶液为KOH溶液,放电时的总反应:3Zn+2K2FeO4+8H2O→3Zn(OH)2+2Fe(OH)3+4KOH
①写出正极发生的电极反应式:_________________。
②用高铁(VI)电池作电源,以Fe作阳极,以Cu作阴极,对足量KOH溶液进行电解,当电池中有0.2mol
K2FeO4反应时,则在电解池中生成H2_________L(标准状况)。
③下表列出了某厂排放的含锌废水中的含量及国家环保标准值的有关数据
该厂只用调节pH处理废水,当调整为pH=7时,此时废水中Zn2+的浓度为_______mg/L,_______(填“符合”或“不符合”)国家环保标准。(常温下,Ksp[Zn(OH)2]=1.2×10-17)
参考答案:(1)AD
(2)①10OH-+3ClO-+2Fe3+=3Cl-+2FeO42-+5H2O
(3)①FeO42-+4H2O+3e-=Fe(OH)3+5OH-;②6.72;③78;不符合
本题解析:
本题难度:一般
4、选择题 碱性电池具有容量大、放电电流大的特点,因而得到广泛应用.锌-锰干电池以KOH溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s)下列说法错误的是( )
A.电池工作时,锌失去电子
B.外电路中每通过0.2mol电子,锌的质量理论上减少6.5g
C.电池正极的电极反应式为:2MnO2(s)+H2O(l)+2e-=Mn2O3(s)+2OH-
D.电池工作时,电子由正极通过导线流向负极
参考答案:D
本题解析:
本题难度:一般
5、选择题 如图是一电池,下列有关说法正确的是
A.该电池负极反应为:2Fe2+-2e-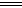 2Fe3+
2Fe3+
B.当有6.02×1023电子转移时,Fe电极减少56g
C.石墨电极上发生氧化反应
D.盐桥中K+移向FeCl3溶液
参考答案:D
本题解析:该原电池中,铁作负极,石墨作正极,A.负极上铁失电子发生氧化反应,电极反应式为:Fe-2e-═Fe2+,A错误;B.当有6.02×1023电子转移时,Fe电极减少的质量=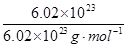 ×
× ×56g·mol-1=28g,B错误;C.石墨作正极,正极上铁离子得电子发生还原反应,C错误;D.盐桥中K+移向正极电解质溶液,即移向FeCl3溶液,D正确;选D.
×56g·mol-1=28g,B错误;C.石墨作正极,正极上铁离子得电子发生还原反应,C错误;D.盐桥中K+移向正极电解质溶液,即移向FeCl3溶液,D正确;选D.
本题难度:一般