时间:2019-07-04 00:35:59
1、填空题 已知25℃时弱电解质电离平衡常数:
Ka(CH3COOH) l.8 xl0-5,Ka(HSCN) 0.13
(1)将20mL,0.10mol/L CH3COOH溶液和20mL,0.10mol/L的HSCN溶液分别与0.10mol/L的NaHCO3溶液反应,实验测得产生CO2气体体积(V)与时间t的关系如图。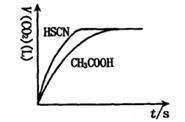
反应开始时,两种溶液产生CO2的速率明显不同的原因是 ;
反应结束后所得溶液中c(SCN-)____ c(CH3COO-)(填“>”,“=”或“<”)。
(2)2.0×l0-3mol/L的氢氟酸水溶液中,调节溶液pH(忽略调节时体积变化),测得平衡体系中c(F-),c(HF)与溶液pH的关系如下图。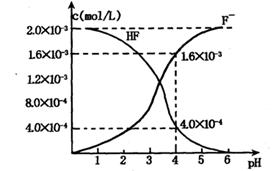
则25℃时,HF电离平衡常数为:(列式求值)Ka(HF)=
(3)难溶物质CaF2溶度积常数为:Ksp= 1.5×10-10,将4.0×10-3mol/L HF溶液与4.0×l0-4 mol/L的CaCl2溶液等体积混合,调节溶液pH =4(忽略调节时溶液体积变化),试分析混合后是否有沉淀生成?____ (填“有”或“没有”),筒述理由: 。
2、选择题 醋酸溶液中存在电离平衡CH3COOH H++CH3COO-,下列叙述不正确的是
H++CH3COO-,下列叙述不正确的是
A.升高温度,平衡正向移动,醋酸的电离常数Ka值增大
B.0.10mol/L的CH3COOH溶液中加水稀释,溶液中c(OH-)增大
C.CH3COOH溶液中加少量的CH3COONa固体,平衡逆向移动
D.25℃时,欲使醋酸溶液的pH、电离常数Ka和电离程度都减小,可加入少量冰醋酸
3、填空题 (6分)在25℃时,将酸HA与碱MOH等体积混合.
(1)若0.01mol/L的强酸HA与0.01mol/L强碱MOH混合,则所得溶液显 (填“酸性”、“中性”或“碱性”,下同)该反应的离子方程式为 。
(2)若PH=3的强酸HA与PH=11的弱碱MOH混合,则所得溶液显 ,
理由是 。
(3)若0.01mol/L的强酸HA与0.01mol/L弱碱MOH混合,则所得溶液显 ,解释这一现象的离子方程式是 。
4、填空题 (10分)已知室温时,0.1 mol·L-1某一元酸HA在水中有0.1%发生电离,回答下列问题:
(1)该溶液的pH=________;
(2)HA的电离平衡常数K=________;
(3)升高温度时,K将______(填“增大”、“减小”或“不变”),pH将______(填“增大”、“减小”或“不变”);
(4)由HA电离出的c(H+)约为水电离出的c(H+)的________倍。
5、选择题 常温下,对下列四种溶液的叙述正确的是( )
| 编号 | ① | ② | ③ | ④ 溶液 氨水 氢氧化钠溶液 醋酸溶液 盐酸 pH 11 11 3 3 |