时间:2019-07-04 00:35:18
1、填空题 已知水在25℃和95℃时,其电离平衡曲线如 www.91eXam.org图所示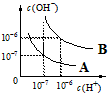
(1)则25℃时水的电离平衡曲线应为_____(填“A”或“B”)请说明理由_______________________。
(2)25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为_______________。
(3)95℃时,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,pH1与pH2之间应满足的关系是______________________。
(4)曲线B对应温度下,pH=2的某HA溶液和pH=10的NaOH溶液等体积混合后,混合溶液的pH=5。请分析其原因:______________________。
2、选择题 水的电离过程为H2O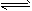 H++OH-,在25℃时,水的离子积:KW=1×10-14,在35℃时,水的离子积:
H++OH-,在25℃时,水的离子积:KW=1×10-14,在35℃时,水的离子积:
KW(35℃)=2.1×10-14,则下列叙述正确的是
[? ]
A.c(H+)随着温度的升高而降低
B.35℃时,c(H+)<c(OH-)
C.35℃时的水比25℃时的水电离程度小
D.水的电离是吸热的
3、填空题 (14分)亚硝酸盐是一种常见的食品添加剂,使用时必须严格控制其用量。为检测某食品中亚硝酸盐含量(通常以1kg样品中含NaNO2的质量计),某研究小组设计了如下两种实验方案:(提示 : 无色气体B遇空气显红棕色)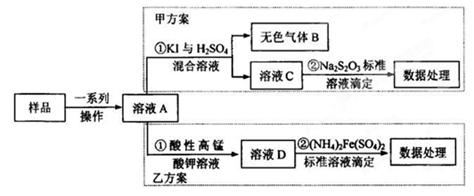
(1)甲方案②中常用 做指示剂。若需配制80 mL0.001 mol·L-1的Na2S2O3标准溶液。现给出下列仪器(配制过程中可能用到):①50 mL烧杯②胶头滴管③天平④80 mL容量瓶⑤100 mL容量瓶⑥玻璃棒,按使用仪器的先后顺序排列正确的是
A.③①⑤⑥②
B.③①⑥④②
C.③①⑥⑤②
D.③①④⑥②
请写出配制Na2S2O3标准溶液时定容的操作
(2)已知酸性条件下MnO4—被还原为Mn2+,请写出乙方案①的离子方程式
(3)若取样品ag,按乙方案进行测定,准确量取12.00mL0.0005mol/L的酸性KMnO4溶液(过量)与溶液A反应。反应后溶液用0.0010mol/L(NH4)2Fe(SO4)2标准溶液滴定至溶液紫色刚好褪去;重复上述实验2次,平均消耗(NH4)2Fe(SO4)2溶液10.00mL.则1kg样品中 NaNO2的质量为_______mg.
(4)若乙方案②中使用的(NH4)2Fe(SO4)2溶液暴露在空气中时间过长,则会导致测定出的NaNO2含量 (填“偏高”、“偏低”或“不影响”)
(5)小组经过讨论,认为 方案更佳,原因是 。
4、填空题 某探究小组将一批电子废弃物简单处理后,得到含Cu、Al、Fe及少量Au、Pt等金属的混合物,并设计如下制备硫酸铜晶体和无水氯化铁的方案:
已知:Cu2+ + 4NH3·H2O=[Cu(NH3)4]2+ + 4H2O
请回答下列问题:
(1)步骤①Cu与酸反应的离子方程式为 。
(2)步骤②加H2O2的作用是 ,滤渣2为(填化学式) 。
(3)步骤⑤不能直接加热脱水的理由是 。
(4)若滤液1中Cu2+的浓度为0.02mol·L-1,则氢氧化铜开始沉淀时的pH =
(已知:Ksp[Cu(OH)2]=2.0×10-20)。
(5)已知:2Cu2++4I-= 2CuI↓+I2 I2+2S2O32-= 2I-+S4O62-
某同学为了测定CuSO4·5H2O产品的质量分数可按如下方法:取3.00g产品,用水溶解后,加入足量的KI溶液,充分反应后过滤、洗涤,将滤液稀释至250mL,取50mL加入淀粉溶液作指示剂,用0.080 mol·L-1 Na2S2O3标准溶液滴定,达到滴定终点的依据是 。
四次平行实验耗去Na2S2O3标准溶液数据如下:
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗Na2S2O3标准溶液(mL) | 25.00 | 25.02 | 26.20 | 24.98 |
5、填空题 (7分)(1)若把H2O2看成是二元弱酸,请写出在水中的电离方程式:
_____________________________ ____
(2)碘也可用作心脏起搏器电源—锂碘电池的材料。该电池反应为2Li(s)+I2(s)==="2LiI(s)" ΔH
已知:①4Li(s)+O2(g)===2Li2O(s) ΔH1 ②4LiI(s)+O2(g)===2I2(s)+2Li2O(s) ΔH2
则电池反应的ΔH=__________
(3)某温度时,在2 L容器中X、Y、Z三种气体的物质的量随时间变化的曲线如图所示。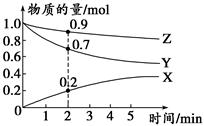
由此分析,该反应的化学方程式为______________ __________;
从反应开始至2 min时,Z的反应速率为____________。
(4)在某温度时,测得0.01 mol·L-1的NaOH溶液的pH=10。在此温度下,将1mL 0.1mol/L KOH溶液加水稀释至1L,则溶液的pH为 ,若加水稀释至1000L,则溶液的pH为 。