时间:2019-07-04 00:21:10
1、实验题 (13分)有一固体样品,其中只含有Na2 CO3?10H2O和NaH
CO3?10H2O和NaH CO3.为了测定样品中Na2CO3的质量分数,请从下图中选用适当的实验装置,设计一个最简单的实验,测定固体样品中Na2CO3的质量分数。
CO3.为了测定样品中Na2CO3的质量分数,请从下图中选用适当的实验装置,设计一个最简单的实验,测定固体样品中Na2CO3的质量分数。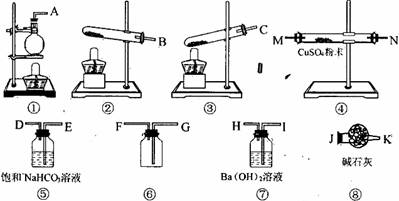
请填写下列各空:
(1)应选用的装置是(只写装置的代号,装置不重复)_________________,所选用装置的连接顺序是(填接口的字母):_______接_______,_______接_______,_______接_______ ……。
(2)装置⑥中应盛放的试剂是__________________,其作用是_____________________。
(3)选用 的装置连接好后,最后一个装置的作用是_______________________________。
的装置连接好后,最后一个装置的作用是_______________________________。
(4)写出吸收CO2的离子方程式____________________________________。
(5)停止加热时,正确的操作是____________________________________。
(6)取m g固体样品实验,经测定m g固体样品在加热时,完全分解,可得agCO2,则m g样品中所含。Na2CO3的质量分数为________________________________。(用含m、a的代数式表示)
2、填空题 某校学生课外活动小组的同学设计下图甲所示实验装置,用来验证一氧化碳具有还原性.
回答下列问题.
(1)写出装置A中发生反应的离子方程式______
(2)装置B中最适宜的试剂是______.
(3)装置D中黑色固体为______(填名称),反应的化学方程式为______.
(4)按照如图装置进行实验时,首先进行的操作是______
(5)根据实验中的______现象,可证明CO具有还原性,有关反应的化学方程式是______.
(6)若要根据装置F中澄清石灰水变浑浊的现象确认一氧化碳具有还原性,应在上图装置______与______之间连接下图乙中的______装置(填序号).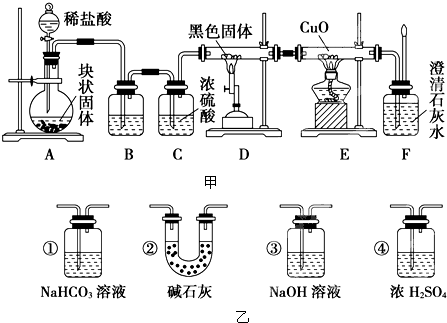
3、实验题 实验题:现有药品:W g(W<1)锌片、稀硫酸、无水硫酸铜、氧化铜和水。请从图中选用适当的实验装置,设计一个简单的实验,粗略测定锌的相对原子质量(假设环境为标准状况)。
(1)应选用的装置是(只要求写出图中装置的标号)?。
(2)所用装置的连接顺序是(填各接口的字母,胶管省略)?。
(3)为了保证不漏出氢气,操作中加放试剂 的方法是?。
的方法是?。
(4)用实验所测得的数据,写出计算锌的相对原子质量的数学式:Mr(Zn)=?。
4、简答题 卤块的主要成分是MgCl2,此外还含Fe3+、Fe2+和Mn2+等离子.以卤块为原料可制得轻质氧化镁,工艺流程如图: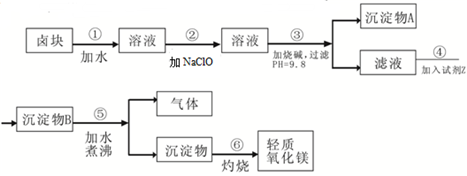
已知:Fe2+氢氧化物呈絮状,不易从溶液中除去,所以常将它氧化为Fe3+,生成Fe(OH)3沉淀除去.若要求产品尽量不含杂质,请根据表1表2提供的资料,填写空白:
表1生成氢氧化物沉淀的pH
| 物质 | 开始沉淀 | 沉淀完全 Fe(OH)3 2.7 3.7 Fe(OH)2 7.6 9.6 Mn(OH)2 8.3 9.8 Mg(OH)2 9.6 11.1 |
| 试剂 | 价格(元/吨) 漂液(含NaClO,25.2%) 450 双氧水(含H2O2,30%) 2400 烧碱(含98%NaOH) 2100 纯碱(含99.5%Na2CO3) 600 |
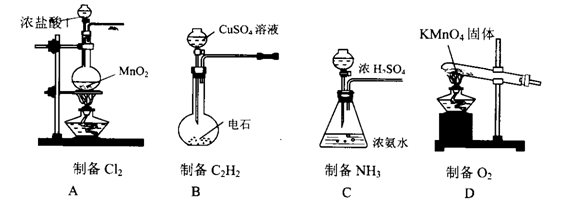
5、选择题 下列有关气体制备的实验,其中装置和药品选用不正确的是?(?)