时间:2019-07-04 00:02:43
1、填空题 发射卫星用N2H4作燃料,NO2作氧化剂,两者反应生成N2和水蒸气,
已知:N2(g)+O2(g)=2NO2(g)△H1=+67.7kJ/mol
N2H4(g)+O2(g)=N2(g)+2H2O(g)△H2=-534kJ/mol
试写出N2H4与?NO2反应的热化学方程式______.
参考答案:①N2(g)+O2(g)=2NO2(g)△H1=+67.7kJ/mol
②N2H4(g)+O2(g)=N2(g)+2H2O(g)△H2=-534kJ/mol
依据盖斯定律:②×2-①得到:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1135.7KJ/mol;
故答案为:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1135.7KJ/mol.
本题解析:
本题难度:一般
2、填空题 根据下列条件计算有关反应的焓变:
(1)已知:
Ti(s)+2Cl2(g)===TiCl4(l) ΔH=-804.2 kJ·mol-1
2Na(s)+Cl2(g)==="2NaCl(s)" ΔH=-882.0 kJ·mol-1
Na(s)===Na(l) ΔH=+2.6 kJ·mol-1
则反应TiCl4(l)+4Na(l)===Ti(s)+4NaCl(s)的ΔH= kJ·mol-1。
(2)已知下列反应数值:
| 序号 | 化学反应 | 反应热 |
| ① | Fe2O3(s)+3CO(g)=== 2Fe(s)+3CO2(g) | ΔH1=-26.7 kJ·mol-1 |
| ② | 3Fe2O3(s)+CO(g)===2Fe3O4(s)+CO2(g) | ΔH2=-50.8 kJ·mol-1 |
| ③ | Fe3O4(s)+CO(g)===3FeO(s)+CO2(g) | ΔH3=-36.5 kJ·mol-1 |
| ④ | FeO(s)+CO(g)===Fe(s)+CO2(g) | ΔH4 |
参考答案:(1)-970.2 (2)+7.3
本题解析:(1)由已知反应得:
TiCl4(l)===Ti(s)+2Cl2(g) ΔH=+804.2 kJ·mol-1①
4Na(s)+2Cl2(g)==="4NaCl(s)" ΔH=-1764.0 kJ·mol-1②
4Na(s)===4Na(l) ΔH=+10.4 kJ·mol-1。③
根据盖斯定律,将①+②-③得:
TiCl4(l)+4Na(l)===Ti(s)+4NaCl(s)ΔH=+804.2 kJ·mol-1-1 764.0 kJ·mol-1-10.4 kJ·mol-1=-970.2 kJ·mol-1。
(2)根据盖斯定律,将(①×3-②-③×2)/6得:
FeO(s)+CO(g)===Fe(s)+CO2(g),则ΔH4=(ΔH1×3-ΔH2-ΔH3×2)/6≈+7.3 kJ·mol-1。
本题难度:一般
3、填空题 (每空2分,共6分)依据事实,写出下列反应的热化学方程式。
(1)在25 ℃、101 kPa下,1 g甲醇燃烧生成CO2和液态水时放热22.68 kJ。则表示甲醇燃烧热的热化学方程式为________________________________________________。
(2)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热为-57.3kJ/mol): ___________________________________________________。
(3)肼可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气。
已知:①N2(g)+2O2(g)= N2O4(1) △H1= -19.5kJ·mol-1
②N2H4(1) + O2(g)= N2(g) + 2 H2O(g) △H2= -534.2kJ·mol-1
写出肼和N2O4反应的热化学方程式
参考答案:(1).CH3OH(l)+3/2O2(g)===CO2(g)+2H2O(l) △H= —725.8 kJ/mol
(2)1/2H2SO4(aq)+NaOH(aq)=1/2Na2SO4(aq)+H2O(l) ΔH=-57.3 kJ/mol
(3)2N2H4(1)+N2O4(1)==3N2(g)+4H2O(g) △H= -1048.9kJ·mol-1
本题解析:在25 ℃、101 kPa下,1 g甲醇燃烧生成CO2和液态水时放热22.68 kJ,故1mol甲醇完全燃烧放出热量为:22.68×32=725.68 kJ/mol,故甲醇燃烧热的热化学方程式为CH3OH(l)+3/2O2(g)===CO2(g)+2H2O(l) △H= —725.8 kJ/mol;中和热为酸碱中和生成1mol水的反应,故稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式1/2H2SO4(aq)+NaOH(aq)=1/2Na2SO4(aq)+H2O(l) ΔH=-57.3 kJ/mol;由盖斯定律可知:2N2H4(1)+N2O4(1)==3N2(g)+4H2O(g) △H=2×(-534.2 kJ/mol)-(-19.2 kJ/mol)= -1048.9kJ·mol-1。
考点:化学反应能量变化。
本题难度:一般
4、填空题 (18分)为减小CO2对环境的影响,在限制其排放量的同时,应加强对CO2创新利用研究。
(1)如将CO2与H2以1:3的体积比混合。
①适当条件下合成某烃和水,该烃是___ _(填序号)。
A.烷烃
B.烯烃
C.炔烃
D.苯的同系物
②适当条件下合成燃料甲醇和水。在体积为2L的密闭容器中,充入2 mol CO2和6 mol H2,
一定条件下发生反应:CO2(g) + 3H2(g) = CH3OH(g) + H2O(g) △H=-49.0 kJ/mol
测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。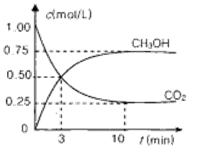
的转化率= ;能使平衡体系中n(CH3OH)增大的措施有 。
(2)如将CO2与H2以1:4的体积比混合,在适当的条件下可制得CH4。
己知:①CH4(g)+2O2(g)=CO2(g)+2H2O( l ) △H=-890. 3kJ/mol
②2H2(g)+O2(g)=2H2O(l) △H=-571.6kJ/mol
则CO2(g)与H2(g)反应生成CH4(g)与液态水的热化学方程式是 。
(3)最近科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使空气中的CO2转变为可再生燃料甲醇。甲醇可制作燃料电池。写出以氢氧化钾为电解质的甲醇燃料电池负极反应式 。当电子转移的物质的量为________时,参加反应的氧气的体积是6.72L(标准状况下)。
(4)某同学用沉淀法测定含有较高浓度CO2的空气中CO2的含量,经查得一些物质在20℃的数据如下表。
| 溶解度(s)/g | 溶度积(Ksp) | ||
| Ca(OH)2 | Ba(OH)2 | CaCO3 | BaCO3 |
| 0.16 | 3.89 | 2.9×10-9 | 2.6×10-9 |
参考答案:(1)①B;② 平衡常数表达式K= ;v(H2)=0.225 mol/(L·min); 75%;降低温度或加压或增大H2的量等;
;v(H2)=0.225 mol/(L·min); 75%;降低温度或加压或增大H2的量等;
(2)CO2(g) + 4H2(g) ==CH4(g)+ 2H2O(l) ΔH=-253.9kJ/mol
(3)CH3OH-6e-+8OH-= CO32-+6H2O; 1.2mol ;(4)Ba(OH)2 。
本题解析:(1)如将CO2与H2以1:3的体积比混合。①适当条件下合成某烃和水,根据质量守恒定律可得:2CO2+6H2=C2H4+4H2O所以该烃是烯烃,选项是B;②反应CO2(g) + 3H2(g) = CH3OH(g) + H2O(g)的平衡表达式是K= 。v(H2) :V(CO2)="3:1," V(CO2)=0.75mol/L÷10min=0.075mol/(L·min),所以v(H2) ="3" V(CO2)=" 3×0.075mol/(L·min)=" 0.225 mol/(L·min);从反应开始至平衡,CO2改变浓度是0.75mol/L,则H2改变浓度是2.25mol/L,所以氢气的转化率=(2.25mol/L÷3mol/L)×100%=75%;若使平衡体系中n(CH3OH)增大,则应该使平衡正向移动。根据平衡移动原理,可知采取的措施有降低温度或加压或增大H2的量等;(2)②×2—①,整理可得:CO2(g) + 4H2(g) ==CH4(g)+ 2H2O(l) ΔH=-253.9kJ/mol;(3)以氢氧化钾为电解质的甲醇燃料电池中,通入甲醇的电极是负极,负极反应式是CH3OH-6e-+8OH-= CO32-+6H2O; n(O2)= 6.72L÷22.4L/mol=0.3mol。由于在氧化还原反应中电子转移数目相等。所以n(e-)=0.3mol×4=1.2mol。(4)由于CaCO3、BaCO3的溶度积常数相差不大,而物质的溶解度:Ca(OH)2的溶解度小于Ba(OH)2,所以吸收CO2最合适的试剂是Ba(OH)2溶液。
。v(H2) :V(CO2)="3:1," V(CO2)=0.75mol/L÷10min=0.075mol/(L·min),所以v(H2) ="3" V(CO2)=" 3×0.075mol/(L·min)=" 0.225 mol/(L·min);从反应开始至平衡,CO2改变浓度是0.75mol/L,则H2改变浓度是2.25mol/L,所以氢气的转化率=(2.25mol/L÷3mol/L)×100%=75%;若使平衡体系中n(CH3OH)增大,则应该使平衡正向移动。根据平衡移动原理,可知采取的措施有降低温度或加压或增大H2的量等;(2)②×2—①,整理可得:CO2(g) + 4H2(g) ==CH4(g)+ 2H2O(l) ΔH=-253.9kJ/mol;(3)以氢氧化钾为电解质的甲醇燃料电池中,通入甲醇的电极是负极,负极反应式是CH3OH-6e-+8OH-= CO32-+6H2O; n(O2)= 6.72L÷22.4L/mol=0.3mol。由于在氧化还原反应中电子转移数目相等。所以n(e-)=0.3mol×4=1.2mol。(4)由于CaCO3、BaCO3的溶度积常数相差不大,而物质的溶解度:Ca(OH)2的溶解度小于Ba(OH)2,所以吸收CO2最合适的试剂是Ba(OH)2溶液。
考点:考查物质的火车产物、化学平衡常数的表达式、化学反应速率和物质的转化率的计算、热化学方程式的书写、燃料电池的反应原理、电子转移及气体吸收试剂的选择的知识。
本题难度:一般
5、填空题 (16分)制备氢气可利用碘硫热化学循环法,其原理示意图如下。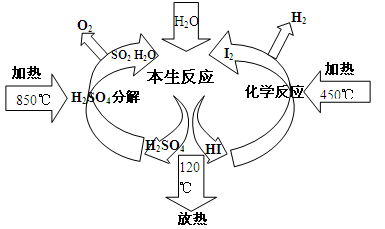
(1)已知:①2SO3(g) 2SO2 (g) + O2 (g) △H1
2SO2 (g) + O2 (g) △H1
②H2SO4(l) SO3(g) + H2O(l) △H2
SO3(g) + H2O(l) △H2
2H2SO4(l) 2SO2 (g) + O2(g) +2H2O(l) △H3
2SO2 (g) + O2(g) +2H2O(l) △H3
则△H3= (用△H1和△H2表示)
(2)上述热化学循环制氢要消耗大量的能量,从绿色化学角度,能量供应的方案是 。
(3)碘化氢热分解反应为:2HI(g) H2(g)+I2(g) △H>0。则该反应平衡常数表达式:K= ;升温时平衡常数K (选填“增大”或“减小”)
H2(g)+I2(g) △H>0。则该反应平衡常数表达式:K= ;升温时平衡常数K (选填“增大”或“减小”)
(4)本生(Bunsen)反应中SO2和I2及H2O发生反应为:
SO2+I2+2H2O=3H++HSO4─+2I─;I─+I2 I3─。
I3─。
①当起始时,SO2为1mol,水为16mol,溶液中各离子变化关系如下图,图中a、b分别表示的离子是 、 。
②在水相中进行本生反应必须使水和碘显著过量,但易引起副反应将反应器堵塞。写出浓硫酸与HI发生反应生成硫和碘的化学方程式: 。
参考答案:(1)△H1+2△H2(2分)
(2)用廉价的清洁能源供给能量(用太阳能、风能、核能及生物质能等作为能源)(2分)
(3)c(H2)·c(I2)/c2(HI) (3分); 增大(2分);
(4)①H+、 I3- (各2分);②6HI+H2SO4(浓)=3I2↓+S↓+4H2O(3分)
本题解析:(1)①+②×2,整理可得2H2SO4(l) 2SO2 (g) + O2(g) +2H2O(l) △H3=△H1+2△H2;(2)上述热化学循环制氢要消耗大量的能量,从绿色化学角度,能量供应的方案是用廉价的清洁能源供给能量(用太阳能、风能、核能及生物质能等作为能源)(3)碘化氢热分解反应为:2HI(g)
2SO2 (g) + O2(g) +2H2O(l) △H3=△H1+2△H2;(2)上述热化学循环制氢要消耗大量的能量,从绿色化学角度,能量供应的方案是用廉价的清洁能源供给能量(用太阳能、风能、核能及生物质能等作为能源)(3)碘化氢热分解反应为:2HI(g) H2(g)+I2(g) △H>0。化学平衡常数是可逆反应达到平衡状态时,各种生成物浓度幂之积与各种反应物浓度幂之积的比。则该反应平衡常数表达式:K=c(H2)·c(I2)/c2(HI);由于该反应的正反应是吸热反应,根据平衡移动原理:升温时平衡向吸热的正反应方向移动,所以化学常数K增大;(4)①根据方程式中各种微粒的关系及图像显示的微粒的浓度变化可知:a表示的是H+;b表示的是I3-;②在水相中进行本生反应必须使水和碘显著过量,但易引起副反应将反应器堵塞。浓硫酸有强的氧化性,而HI有还原性,二者会发生氧化还原反应生成硫和碘,根据电子守恒和原子守恒,可得反应的化学方程式:6HI+H2SO4(浓)=3I2↓+S↓+4H2O。
H2(g)+I2(g) △H>0。化学平衡常数是可逆反应达到平衡状态时,各种生成物浓度幂之积与各种反应物浓度幂之积的比。则该反应平衡常数表达式:K=c(H2)·c(I2)/c2(HI);由于该反应的正反应是吸热反应,根据平衡移动原理:升温时平衡向吸热的正反应方向移动,所以化学常数K增大;(4)①根据方程式中各种微粒的关系及图像显示的微粒的浓度变化可知:a表示的是H+;b表示的是I3-;②在水相中进行本生反应必须使水和碘显著过量,但易引起副反应将反应器堵塞。浓硫酸有强的氧化性,而HI有还原性,二者会发生氧化还原反应生成硫和碘,根据电子守恒和原子守恒,可得反应的化学方程式:6HI+H2SO4(浓)=3I2↓+S↓+4H2O。
考点:考查化学方程式和热化学方程式的书写、化学方案的设计、化学平衡常数的表达及影响因素的知识。
本题难度:困难