时间:2019-07-04 00:02:43
1、选择题 已知C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) ΔH1=-a kJ/mol
C2H5OH(g)=C2H5OH(l) ΔH2=-b kJ/mol
H2O(g)=H2O(l) ΔH3=-c kJ/mol
若使92 g酒精液体完全燃烧,最后恢复到室温,则放出的热量(单位kJ)为( )
A.4a+4b+4c
B.2a-2b+6c
C.2a-2b+2c
D.2a-6b+2c
参考答案:B
本题解析:酒精液体完全燃烧恢复到室温,生成的产物为CO2(g)和H2O(l),根据已知的热化学方程式可知:
C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) ΔH1=-a kJ/mol ①,C2H5OH(g)=C2H5OH(l) ΔH2=-b kJ/mol ②,H2O(g)=H2O(l) ΔH3=
-c kJ/mol ③。常温下C2H5OH(l)完全燃烧生成CO2(g)和H2O(l)的热化学方程式为①-②+3×③,C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l)
ΔH=-(a-b+3c) kJ·mol-1,92 g C2H5OH的物质的量为2 mol,反应放出的热量为(2a-2b+6c) kJ,B项正确。
本题难度:一般
2、填空题 (14分)煤是一种重要的化工原料,人们将利用煤制取的水煤气、焦炭、甲醚等广泛用于工农业生产中。
(1)已知:
①C(s) + H2O(g) === CO(g)+H2(g) ΔH=+131.3 kJ·mol-1
②CO2(g) + H2(g) ===" CO(g)" + H2O(g) ΔH=+41.3 kJ·mol-1
则碳与水蒸气反应生成二氧化碳和氢气的热化学方程式为 。
该反应在 (填“高温”、“低温”或“任何温度”)下有利于正向自发进行。
(2)有人利用炭还原法处理氮氧化物,发生反应C(s)+2NO(g)  N2(g)+CO2(g)。向某密闭容器中加入一定量的活性炭和NO,在T1℃时,不同时间测得各物质的浓度如下表所示:
N2(g)+CO2(g)。向某密闭容器中加入一定量的活性炭和NO,在T1℃时,不同时间测得各物质的浓度如下表所示:
| 时间(min) 浓度(mol·L-1) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
| N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
| CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
 H2(g)+CO2(g)平衡常数随温度的变化如下表所示:
H2(g)+CO2(g)平衡常数随温度的变化如下表所示:| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |

参考答案:(1)C(s) + 2H2O(g) = CO2(g) + 2H2(g)
本题解析:
本题难度:困难
3、填空题 (1)已知拆开1mol H-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2
与H2反应生成NH3的热化学方程式为______________.
(2)已知下列反应的反应热为:
①CH3COOH(l)+2O2(g)= 2CO2(g)+2H2O(l) △H=- 870.3 kJ·mol-1
②C(s)+O2(g) = CO2(g) △H=-393.5 kJ·mol-1
③H2(g)+O2(g) = H2O(l) △H=-285.8 kJ·mol-1
试计算下列反应的反应热:2C(s)+2H2(g)+O2(g) = CH3COOH(l) △H= __________。
参考答案:(1)N2(g)+3H2(g) 2NH3(g) △H=-92KJ/mol?
2NH3(g) △H=-92KJ/mol?
(2) -488.3KJ/mol
本题解析:
本题难度:一般
4、填空题 碳化硅(SiC) 、氧化铝(Al2O3) 和氮化硅(Si3N4)是优良的高温结构陶瓷,在工业生产和科技领域有重要用途。宇宙火箭和导弹中,大量用钛代替钢铁。
(1)Al的离子结构示意图为 ;
Al与NaOH溶液反应的离子方程式为
(2)氮化硅抗腐蚀能力很强,但易被氢氟酸腐蚀,氮化硅与氢氟酸反应生成四氟化硅和一种铵盐,
其反应方程式为
(3)工业上用化学气相沉积法制备氮化硅,其反应如下:
3SiCl4(g) + x N2(g) + 6 H2(g)  Si3N4(s) + 12 HCl(g) △H<0
Si3N4(s) + 12 HCl(g) △H<0
在恒温、恒容时,分别将0.3mol SiCl4(g)、0.2mol N2(g)、0.6mol H2(g)充入2 L密闭容器内,进行上述反应,5 min达到平衡状态,所得HCl(g)为0.3mol/L、 N2为0.05 mol/L
① H2的平均反应速率是
② 反应前与达到平衡时容器内的压强之比=
③ 系数 x =
(4)已知:TiO2(s)+2Cl2(g)===TiCl4(l)+O2(g) ΔH1=+140 kJ·mol-1
C(s)+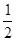 O2(g)=== CO(g) ΔH2 =-110 kJ·mol-1
O2(g)=== CO(g) ΔH2 =-110 kJ·mol-1
写出TiO2和焦炭、氯气反应生成TiCl4和CO气体的热化学方程式:
。
参考答案:(共10分)(1)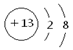 (1分) 2Al +2OH-+2H2O=2AlO2 + 3H2↑ (2分)
(1分) 2Al +2OH-+2H2O=2AlO2 + 3H2↑ (2分)
(2)Si3N4 +16HF=3SiF4 + 4NH4F (2分)
(3)①0.03mol/(L·min) ②11:12 ③x=2 (1分/空,若没有带单位不得分)
(4)TiO2(s)+2Cl2(g)+2 C(s) ===TiCl4(l)+ 2 CO(g) ΔH = - 80 kJ·mol-1(2分)
本题解析:(1)铝离子的核外电子数是8个,所以离子结构示意图为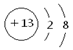 。金属铝能和氢氧化钠溶液反应生成氢气和偏铝酸钠,反应的离子方程式是2Al +2OH-+2H2O=2AlO2 + 3H2↑。
。金属铝能和氢氧化钠溶液反应生成氢气和偏铝酸钠,反应的离子方程式是2Al +2OH-+2H2O=2AlO2 + 3H2↑。
(2)氮化硅与氢氟酸反应生成四氟化硅和一种铵盐,则根据原子守恒可知,该铵盐应该是氟化氨,因此反应的化学方程式是Si3N4 +16HF=3SiF4 + 4NH4F。
(3) 3SiCl4(g) + x N2(g) + 6 H2(g)  Si3N4(s) + 12 HCl(g)
Si3N4(s) + 12 HCl(g)
起始量(mol) 0.3 0.2 0.6 0 0
转化量(mol/L) 0.15 0.05x 0.3 0.05 0.6
平衡量(mol/L) 0.15 0.2-0.05x 0.3 0.05 0.6
则① H2的平均反应速率是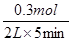 =0.03mol/(L·min)
=0.03mol/(L·min)
② 反应前与达到平衡时容器内的压强之比是
③0.2-0.05x=0.1
解得x=2
(4)根据盖斯定律可知,①+②×2即得到反应TiO2(s)+2Cl2(g)+2 C(s) ===TiCl4(l)+ 2 CO(g),所以该反应的反应热ΔH =140 kJ/mol -110 kJ/mol×2=-80 kJ·mol
考点:考查离子结构示意图、方程式的书写,反应速率、反应热的有关计算
点评:该题是高考中的常见题型,属于中等难度的试题。试题基础性强,在注重考查学生基础知识的同时,侧重考查学生灵活运用基础知识解决实际问题的能力。有助于培养学生的逻辑推理能力,和规范的答题能力。
本题难度:困难
5、填空题 (8分)、(1)写出下列反应的热化学方程式
①1molN2 (g)与适量O2 (g)反应生成NO(g),需吸收68kJ的热量
②1g 硫粉在氧气中充分燃烧放出 9.36kJ热量
(2)氢氧燃料电池是将H2通入负极,O2通入正极而发生电池反应的,其能量转换率高。
①若电解质溶液为KOH,其正极反应方程式为:
②若电解质溶液为硫酸,负极反应方程式为: 。
参考答案:(1)①N2(g)+ O2(g)=2NO(g) △H =+68kJ/mol
② S(s)+ O2(g)=S O2(g)△H =-299.52 kJ/mol
(2) ① O2 + 4 e-+ 2 H2O=4OH- ②2 H2-4e-= 4 H+ (每小题2分)
本题解析:考查热化学方程式即电极反应式的书写。热化学方程式是表示化学反应与反应热关系的方程式。书写和应用热化学方程式时必须注意以下几点:
①明确写出反应的计量方程式,各物质化学式前的化学计量系数可以是整数,也可以是分数。
②各物质化学式右侧用圆括弧()表明物质的聚集状态。可以用g、l、s分别代表气态、液态、固态。固体有不同晶态时,还需将晶态注明,例如S(斜方),S(单斜),C(石墨),C(金刚石)等。溶液中的反应物质,则须注明其浓度,以aq代表水溶液,(aq) 代表无限稀释水溶液。
③反应热与反应方程式相互对应。若反应式的书写形式不同,则相应的化学计量系数不同,故反应热亦不同。
④热化学方程式必须标明反应的浓度、温度和压力等条件,若在常温常压时可省略。
(1)①反应是吸热的,所以热化学方程式是N2(g)+ O2(g)=2NO(g) △H =+68kJ/mol
②1g 硫粉在氧气中充分燃烧放出 9.36kJ热量,则1molS燃烧放出的热量是 9.36kJ×32=299.52 kJ,所以热化学方程式是S(s)+ O2(g)=S O2(g)△H =-299.52 kJ/mol
(2)原电池中负极失去电子,正极得到电子,所以氢气在负极通入,氧气在正极通入,如果电解质溶液为KOH,则正极反应方程式为 O2 + 4 e-+ 2 H2O=4OH-;电解质溶液为硫酸,则负极反应方程式为2 H2-4e-= 4 H+。
本题难度:一般