时间:2019-07-03 23:57:53
1、填空题 (10分)粉末状样品A是由等物质的量的MgO和Al2O3与常见金属氧化物B组成的混合物。A有如下图所示的转化关系。 ?
?
请完成下列问题:?
(1)单质C和H的化学式分别是__________、__________。
(2)写出由I生成J的离子方程式:_____________________________________
(3)写出由F生成G的离子方程式________________________________________
(4)若10.7 g样品A中MgO、Al2O3和B的物质的量均为0.05? mol,则B的化学式为_________。
参考答案:(10分)(每空2分)(1)Al Cl2?(2)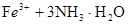 ===
===
(3) ===
=== ? (4)FeO
? (4)FeO
本题解析:红褐色沉淀J,则J应该是氢氧化铁,化合物I和硝酸酸化的硝酸银反应生成白色沉淀,所以K是氯化银。则I是氯化铁,D是单质铁,H是氯气。这说明A中金属氧化物B应该是铁的氧化物,通过铝热反应生成单质铁,所以C是Al。E是氧化镁、氧化铝和过量的铝组成的混合物。氧化镁和氢氧化钠溶液不反应,所以F是偏铝酸钠和氢氧化钠的混合物。偏铝酸钠和CO2反应生成氢氧化铝白色沉淀,则G是氢氧化铝,氢氧化铝分解即生成氧化铝。0.05mol氧化镁和氧化铝的质量分别是2g、5.1g,所以B的质量是10.7g-2g-5.1g=3.6g,因此B的相对分子质量是3.6÷0.05=72,则B是FeO。
点评:化学推断题是一类综合性较强的试题,如元素及化合物性质和社会生活,环境保护,化学计算等知识,还可引入学科间综合。它不仅可考察学生对化学知识的理解程度,更重要的是培养学生的综合分析能力和思维方法。解框图题的方法:最关键的是寻找“突破口”,“突破口”就是抓“特”字,例如特殊颜色、特殊状态、特殊气味、特殊反应、特殊现象、特殊制法、特殊用途等。
本题难度:一般
2、选择题 按图装置持续通入气体X,并在管口P处点燃,实验结果使澄清石灰水变浑浊,则X、Y可能是( )①H2和NaHCO3 ②CO和Na2CO3 ③CO和CuO?④H2和Fe2O3.
A.①④
B.①③
C.②③
D.③④
参考答案:B
本题解析:
本题难度:简单
3、简答题 A、B、C、D、E是中学常见的5种化合物,A、B是氧化物,元素X、Y的单质是生活中常见的金属,相关物质间的关系如图所示.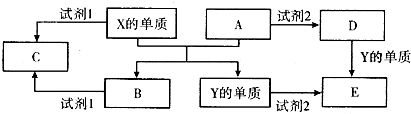
请回答下列问题:
(1)X的单质与A反应的化学方程式是______.
(2)若试剂1是NaOH溶液,X的单质与试剂1反应的离子方程式是______.
(3)若试剂1和试剂2均是稀硫酸.
①检验物质D的溶液中金属离子的方法是______.
②将物质C溶于水,其溶液呈酸性,原因是(用离子方程式表示)______.
③某高效净水剂是由Y(OH)S04聚合得到的.工业上以E、稀硫酸和亚硝酸钠为原料来制备Y(OH)SO4,反应中有NO生成,该反应的化学方程式是______.
参考答案:元素X、Y的单质是生活中常见的金属,Y的用量最大,则X为Al,Y为Fe,A、B是氧化物,则Al与氧化铁反应生成Fe和氧化铝;Al、氧化铝都既能与酸反应又能与碱反应,而Fe、氧化铁都能与酸反应,则试剂1为NaOH溶液时,C为偏铝酸钠;试剂2为硫酸时,D为硫酸铁、E为硫酸亚铁;试剂1为硫酸时,C为硫酸铝,该溶液水解显酸性,
(1)X的单质与A反应为铝热反应,即Al与氧化铁反应生成氧化铝和Fe,该反应为Fe2O3+2Al?高温?.?Al2O3+2Fe,
故答案为:Fe2O3+2Al?高温?.?Al2O3+2Fe;
(2)若试剂1是NaOH溶液,①Al与NaOH溶液反应生成偏铝酸钠和氢气,离子反应为2Al+2H2O+2OH-═2AlO2-+3H2↑,故答案为:2Al+2H2O+2OH-═2AlO2-+3H2↑;
(3)若试剂1和试剂2均是稀硫酸,
①D为硫酸铁,检验铁离子的方法为取少量溶液于试管中,滴加几滴KSCN溶液,溶液变红色,则证明原溶液中含有Fe3+,
故答案为:取少量溶液于试管中,滴加几滴KSCN溶液,溶液变红色,则证明原溶液中含有Fe3+;
②C为硫酸铝,水解显酸性,水解离子反应为Al3++3H2O 
Al(OH)3+3H+,
故答案为:Al3++3H2O 
Al(OH)3+3H+;
③E为硫酸亚铁,与稀硫酸和亚硝酸钠为原料生成Fe(OH)SO4,反应中有NO生成,该反应为2FeSO4+2NaNO2+H2SO4═2Fe(OH)SO4+Na2SO4+2NO↑,
故答案为:2FeSO4+2NaNO2+H2SO4═2Fe(OH)SO4+Na2SO4+2NO↑.
本题解析:
本题难度:一般
4、填空题 (8分)下图是中学化学中常见物质之间的相互转化关系。其中C可用于漂白,空气中M含量增加会导致温室效应。反应③常用于实验室制取气体B。
请回答下列问题:
⑴ ?C的分子式为?,J的电子式为?。
⑵ 写出反应①的离子方程式?。
⑶ 写出反应②的化学方程式?。
⑷?C、M有相似的化学性质,但也有区别,如C有漂白性、M五漂白性。?C、M具有其他不同化学性质的原因是?。
参考答案:
电解
本题解析:本题以无机的框图的形式,考查元素化合物的推导。本题的突破口有,H是黄绿色气体,应为Cl2,J焰色反应为紫色,则含K元素,对G的溶液电解,可以联想电解饱和食盐水,从而确定出G为KCl。反应③为实验室制取气体的反应,其条件为含有MnO2的加热反应,则不难得出K为KClO3,B为O2,G为KCl,由元素守恒知,反应②的产物E为水。A为淡黄色粉未,C用于漂白,由B为O2,可推断出A为S,C为SO2,D为SO3,F为H2SO4。M含量增加会导致温室效应,则为CO2气体,故L为碳。
本题难度:一般
5、填空题 根据图所示的化学反应框图解题.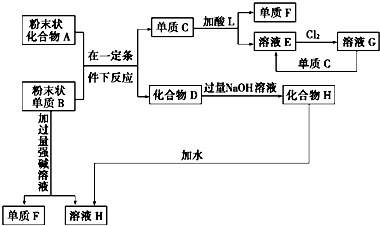
(1)单质 F是______,溶液H中所含的主要离子是______.
(2)写出下列反应的化学方程式:
C+L-→F+E:______;
B-→F+H:______.
(3)写出下列反应的离子方程式:
E+Cl2-→G:______;
G+C-→E:______;
D-→H:______.
(4)由C-→E+F若改用浓酸,则不能选用的浓酸是______(填化学式).
参考答案:根据图示信息,可以知道A+B→C+D的反应属于置换反应,单质B可以和强碱性氢氧化钠发生反应,说明B为金属铝,则A为氧化铁,C为金属铁,D为氧化铝,金属铁可以和酸反应生成亚铁盐和氢气,亚铁盐可以和氯气反应生成三价铁盐,根据转化情况,可以知道E是氯化亚铁,F是氢气,L为盐酸,G为氯化铁,氧化铝可以和氢氧化钠反应生成H为偏铝酸钠,金属铝可以和氢氧化钠反应生成偏铝酸钠和氢气.
(1)单质F是氢气,偏铝酸钠属于可溶于水的盐,溶液中的离子主要是:Na+、AlO2-、OH-,故答案为:H2;Na+、AlO2-、OH-;
(2)金属铁和盐酸的反应为:Fe+2HCl═FeCl2+H2↑,金属铝可以和氢氧化钠反应生成偏铝酸钠和氢气,即2Al+2NaOH+2H2O═2NaAlO2+3H2↑,
故答案为:Fe+2HCl═FeCl2+H2↑;2Al+2NaOH+2H2O═2NaAlO2+3H2↑;
(3)氯气可以将亚铁离子氧化为三价铁离子,即2Fe2++Cl2═2Fe3++2Cl-,金属铁可以和三价铁离子化合生成亚铁离子,即2Fe3++Fe═3Fe2+,氧化铝属于两性氧化物,可以和强碱反应生成偏铝酸钠和水,即Al2O3+2OH-═2AlO2-+H2O,
故答案为:2Fe2++Cl2═2Fe3++2Cl-;2Fe3++Fe═3Fe2+;Al2O3+2OH-═2AlO2-+H2O;
(4)金属铁可以和非氧化性的酸反应生成亚铁盐和氢气,但是和氧化性的酸反应生成的是三价铁盐,不会产生氢气,氧化性的酸如硝酸或是浓硫酸等,故答案为:HNO3、H2SO4.
本题解析:
本题难度:一般