时间:2019-07-03 23:55:50
1、填空题 SO2和NOx在化学工业上有重要用途,也是大气污染的主要来源,开发和利用并重,预防和治理并举是当前工业上和环境保护领域研究的主要课题之一。
(1)在接触法制硫酸的过程中,发生2SO2(g)+O2(g)  2SO3(g) △H<0反应,某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如下图所示,根据图示回答下列问题:
2SO3(g) △H<0反应,某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如下图所示,根据图示回答下列问题:
①平衡状态由A到B时,平衡常数K(A) K(B)(填“>”、“<”或“=”);
②将2.0molSO2和1.0molO2置于10L的密闭容器中,若40s后反应达到平衡,此时体系总压强为0.10MPa,这一段时间内SO2的平均反应速率为 。
该反应的平衡常数为 。
(2)用CH4催化还原NOx可消除氮的氧化物的污染,例如:CH4(g)+4NO2(g) = 4NO(g)+CO2(g)+2H2O(g) △H=-574kJ·mol—1
CH4(g)+4NO(g) = 2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ·mol—1
取标准状况下4.48LCH4并使之完全反应:
①若将NO2还原至N2,整个过程中转移电子的物质的量为 ;
②若还原NO2和NO的混合物,放出的总热量Q的取值范围是 。
2、选择题 已知:Fe(s)+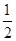 O2(g)==="FeO(s)" ΔH1=-272 kJ/mol
O2(g)==="FeO(s)" ΔH1=-272 kJ/mol
2Al(s)+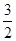 O2(g)===Al2O3(s)ΔH2=-1 675 kJ/mol
O2(g)===Al2O3(s)ΔH2=-1 675 kJ/mol
则2Al(s)+3FeO(s)===Al2O3(s)+3Fe(s)的ΔH是
A.859 kJ/mol
B.-859 kJ/mol
C.-1403 kJ/mol
D.-2491 kJ/mol
3、填空题 (16分)甲烷水蒸气重整制合成气是利用甲烷资源的途径之一,该过程的主要反应是
反应①:CH4(g)+ H2O(g)  CO(g) + 3H2(g) ΔH > 0
CO(g) + 3H2(g) ΔH > 0
(1)已知:
CH4(g)+ 2O2(g) = CO2(g) + 2H2O(g) ΔH1= -802 kJ·mol-1
CO(g) + 1/2O2(g) = CO2(g) ΔH2 = -283 kJ·mol-1
H2(g) + 1/2O2(g) = H2O(g) ΔH3 = -242 kJ·mol-1
则反应①的ΔH =_________(用ΔH1、ΔH2和ΔH3表示)。
(2)其他条件相同,反应①在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下反应相同时间后,CH4的转化率随反应温度的变化如图所示。
①在相同条件下,三种催化剂Ⅰ、Ⅱ、Ⅲ的催化效率由高到低的顺序是________。
②a点所代表的状态________(填“是”或“不是”)平衡状态。
③c点CH4的转化率高于b点,原因是________。
(3)反应①在恒容密闭反应器中进行,CH4和H2O的起始物质的量之比为1
4、填空题 为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究.最近有科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使之变为可再生燃料甲醇.“绿色自由”构想技术流程如下: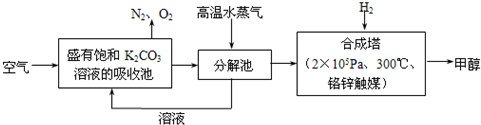
(1)在合成塔中,若有4.4kg?CO2与足量H2恰好完全反应,可放出4947kJ的热量,试写出合成塔中发生反应的热化学方程式是______.
(2)以甲醇为燃料制作新型燃料电池,电池的正极通入O2,负极通入甲醇,在酸性溶液中甲醇与氧作用生成水和二氧化碳.该电池负极发生的反应是:
CH3OH+H2O-6e-═CO2+6H+
则正极发生的反应是______;放电时,H+移向电池的______(填“正”或“负”)极.
(3)常温常压下,饱和CO2水溶液的pH=5.6,c(H2CO3)=1.5×10-5?mol?L-1.若忽略水的电离及H2CO3的第二级电离,则H2CO3?HCO3-+H+的平衡常数K=______.(已知:10-5.6=2.5×10-6)
(4)常温下,0.1mol?L-1NaHCO3溶液的pH大于8,则溶液中c(H2CO3)______c(CO32-)?(填“>”、“=”或“<”),原因是______(用离子方程式和必要的文字说明).
(5)小李同学拟用沉淀法测定空气中CO2的体积分数,他查得CaCO3、BaCO3的溶度积(Ksp)分别为4.96×10-9、2.58×10-9.小李应该选用的试剂是______.
5、填空题 (14分)氮的化合物是一把双刃剑,它既是一种资源,又会给环境造成危害。
Ⅰ.氨气是一种重要的化工原料。
(1)NH3与CO2在120oC,催化剂作用下反应生成尿素:CO2(g) +2NH3(g) (NH2)2CO(s) +H2O(g),在密闭反应容器中,混合气体中NH3的含量变化关系如图所示:
(NH2)2CO(s) +H2O(g),在密闭反应容器中,混合气体中NH3的含量变化关系如图所示: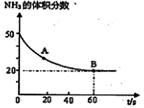
则A点的逆反应速率V(逆)(CO2) B点的正反应速率V(正)(CO2)(填“>”“=”或“<”),氨气的平衡转化率是 。
(2)将一定量的NH2COONH4(s)置于恒温密闭容器中,NH2COONH4(s) 2 NH3(g)+CO2(g),其分解达到平衡状态时,容器内混合气体的平均相对分子质量为 。该反应的化学平衡常数的表达式为________。
2 NH3(g)+CO2(g),其分解达到平衡状态时,容器内混合气体的平均相对分子质量为 。该反应的化学平衡常数的表达式为________。
Ⅱ.氮的氧化物会污染环境。
(3)采取还原法,用炭粉可将氮的氧化物还原。
已知:N2(g)+O2(g)=2NO(g) △H=" +180.6" kJ·mol-1
C(s)+O2(g)=CO2(g) △H= —393.5 kJ·mol-1
写出炭粉还原一氧化氮的热化学反应方程式 。
(4)若用Na2CO3溶液吸收NO2可生成CO2,9.2gNO2和Na2CO3溶液完全反应时转移电子0.1mol,则此反应的离子反应方程式为________。若生成的CO2完全逸出,所得溶液中的离子浓度大小关系为________。