时间:2019-07-03 23:55:50
1、选择题 12g石墨在24g的氧气中燃烧至反应完全,测得放出xkJ的热量,已知石墨的燃烧热为y kJ·mol-1。则石墨与氧气反应生成CO的热化学方程式正确的是
[? ]
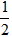 O2(g)=CO(g) △H=-ykJ·mol-1
O2(g)=CO(g) △H=-ykJ·mol-1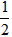 O2(g)=CO(g) △H=-(2x-y)kJ·mol-1
O2(g)=CO(g) △H=-(2x-y)kJ·mol-1参考答案:C
本题解析:
本题难度:一般
2、选择题 沼气是一种能源,它的主要成分是CH4。0.5molCH4完全燃烧生成CO2和液态水时放出445KJ的热量,则下列热化学方程式中正确的是
[? ]
A、2CH4(g)+4O2(g)==?2CO2(g)+4H2O(l);?ΔH=+890kJ/mol?
B、CH4(g)+2O2(g)==?CO2(g)+2H2O(l);?ΔH=+890kJ/mol?
C、CH4(g)+2O2(g)==?CO2(g)+2H2O(l);?ΔH=–890kJ/mol?
D、1/2CH4(g)+?O2(g)==?1/2CO2(g)+?H2O(l);?ΔH=–890kJ/mol?
参考答案:C
本题解析:
本题难度:简单
3、填空题 中国气象局的数据显示,2013年全国平均雾霾天数为52年来之最。形成雾霾的主要成份为:生产生活中排放的废气、汽车尾气及扬尘等。
(1)用CH4可以消除汽车尾气中氮氧化物的污染。
已知:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l) △H=-955 kJ/mol
2NO2(g)=N2O4(g) △H=-56.9 kJ/mol
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式 。
(2)已知:CO(g)+H2O(g) CO2(g)+H2(g) △H=-41kJ/mol,某温度下,向容积为2L的密闭容器中充入2.0molCO(g)和2.0molH2O(g),在tmin时达到平衡,测得放出了32.8kJ热量,则tmin内用H2表示的平均反应速率为 ,由此可知在该温度下反应CO2(g)+H2(g)
CO2(g)+H2(g) △H=-41kJ/mol,某温度下,向容积为2L的密闭容器中充入2.0molCO(g)和2.0molH2O(g),在tmin时达到平衡,测得放出了32.8kJ热量,则tmin内用H2表示的平均反应速率为 ,由此可知在该温度下反应CO2(g)+H2(g) CO(g)+H2O(g)的化学平衡常数为 。相同条件下,向同一密闭容器中充入1.0molCO2和1.0molH2反应达到平衡后,吸收的热量为 kJ。
CO(g)+H2O(g)的化学平衡常数为 。相同条件下,向同一密闭容器中充入1.0molCO2和1.0molH2反应达到平衡后,吸收的热量为 kJ。
(3)碱式硫酸铝法烟气脱硫工艺主要有以下三步
①向Al2(SO4)3溶液中投入粉末状石灰石,生成碱式硫酸铝[Al2(SO4)3·Al2O3]溶液。
②碱式硫酸铝吸收SO2,Al2(SO4)3·Al2O3+3SO2=Al2(SO4)3·Al2(SO3)3,请写出Al2(SO4)3·Al2O3与过量烧碱溶液反应的化学方程式 。
③将Al2(SO4)3·Al2 (SO3)3氧化成Al2(SO4)3,可选用氧化剂为 (填代号)
A.浓硫酸
B.KMnO4溶液
C.5%的H2O2溶液
D.空气
该步反应的目的是 。
参考答案:(1)CH4(g)+N2O4(g) = N2(g) +2H2O(l) + CO2(g) △H=" —898.1" kJ/mol
(2)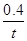 mol/( L·min) 2.25 24.6
mol/( L·min) 2.25 24.6
(3)Al2(SO4)3·Al2O3+3H2O+10NaOH=4Na[Al(OH)4]+3Na2SO4;C D;生成Al2(SO4)3循环使用。
本题解析:(1) 将①式H4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l) △H=-955 kJ/mol 减去②式2NO2(g)=N2O4(g) △H=-56.9 kJ/mol.整理可得:CH4(g)+N2O4(g) = N2(g) +2H2O(l) + CO2(g) △H=" —898.1" kJ/mol 。(2)由方程式可以看出:每生成1mol的H2,放出热量41kJ。现在放出热量32.8kJ,则产生H2的物质的量为32.8÷41=0.8mol。因此在tmin用H2表示的平均反应速率为v(H2)=Δc/Δt=0.8mol÷2L÷tmin=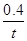 mol/( L·min). (2) 对于反应CO(g)+H2O(g)
mol/( L·min). (2) 对于反应CO(g)+H2O(g)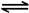 CO2(g)+H2(g)来说, 当反应达到平衡时,c(CO)=c(H2O)=(2.0-0.8)mol÷2L=0.6mol/L ;c(CO2)=c(H2)=0.8mol÷2L=0.4mol/L;该反应的化学平衡常数
CO2(g)+H2(g)来说, 当反应达到平衡时,c(CO)=c(H2O)=(2.0-0.8)mol÷2L=0.6mol/L ;c(CO2)=c(H2)=0.8mol÷2L=0.4mol/L;该反应的化学平衡常数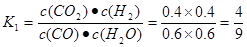 而反应 CO2(g)+H2(g)
而反应 CO2(g)+H2(g)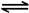 CO(g)+H2O(g)是CO(g)+H2O(g)
CO(g)+H2O(g)是CO(g)+H2O(g)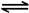 CO2(g)+H2(g)的逆反应。该反应的化学平衡常数为
CO2(g)+H2(g)的逆反应。该反应的化学平衡常数为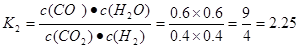 .在相同条件下,向同一密闭容器中充入1.0molCO2和1.0molH2。假如反应达到平衡时产生的CO为xmol,则水蒸气也是xmol,未反应的CO2(g)和H2(g)的物质的量都是(1.0-x)mol.
.在相同条件下,向同一密闭容器中充入1.0molCO2和1.0molH2。假如反应达到平衡时产生的CO为xmol,则水蒸气也是xmol,未反应的CO2(g)和H2(g)的物质的量都是(1.0-x)mol.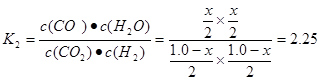 .解得x=0.6mol.因此反应达到平衡后,吸收的热量为0.6mol×41kJ/mol=24.6kJ.(3)因为Al2(SO4)3、Al2O3都能与NaOH发生反应。因此Al2(SO4)3·Al2O3与过量烧碱溶液反应就可以看作是Al2(SO4)3、Al2O3的混合物与NaOH溶液发生的反应。该反应的化学方程式为:Al2(SO4)3·Al2O3+3H2O+10NaOH=4Na[Al(OH)4]+3Na2SO4.③将Al2(SO4)3·Al2 (SO3)3氧化成Al2(SO4)3时选择的氧化剂不能引入新的杂质离子,或者引入的杂质离子容易除去。根据题目提供的试剂可选择绿色氧化剂5%的H2O2溶液或空气。因此选项为C D。该步反应的目的是将Al2(SO4)3·Al2 (SO3)3氧化成Al2(SO4)3,以达到物质的循环利用,提高经济效益。
.解得x=0.6mol.因此反应达到平衡后,吸收的热量为0.6mol×41kJ/mol=24.6kJ.(3)因为Al2(SO4)3、Al2O3都能与NaOH发生反应。因此Al2(SO4)3·Al2O3与过量烧碱溶液反应就可以看作是Al2(SO4)3、Al2O3的混合物与NaOH溶液发生的反应。该反应的化学方程式为:Al2(SO4)3·Al2O3+3H2O+10NaOH=4Na[Al(OH)4]+3Na2SO4.③将Al2(SO4)3·Al2 (SO3)3氧化成Al2(SO4)3时选择的氧化剂不能引入新的杂质离子,或者引入的杂质离子容易除去。根据题目提供的试剂可选择绿色氧化剂5%的H2O2溶液或空气。因此选项为C D。该步反应的目的是将Al2(SO4)3·Al2 (SO3)3氧化成Al2(SO4)3,以达到物质的循环利用,提高经济效益。
考点:考查热化学方程式的书写、化学反应速率、化学平衡产生的计算、可逆反应的热效应、碱式硫酸铝吸收SO2的反应原理等知识。
本题难度:困难
4、简答题 (1)已知含11.2g?KOH的稀溶液与1L0.1mol?L-1的H2SO4稀溶液反应放出11.46KJ的热量.请写出KOH的稀溶液与的H2SO4稀溶液发生中和反应,表示中和热的热化学方程式为______
(2)在相同条件下,下列两个反应的反应热分别为△H1和△H2表示:
①2H2?(g)+O2(g)=2H2O(g)△H1,
②2H2?(g)+O2(g)=2H2O(l)△H2,则△H1和△H2的关系为______.
参考答案:(1)n(KOH)=11.2g56g/mol=0.2mol,n(H2SO4)=1L×0.1mol/L=0.1mol,二者恰好反应生成0.2mol水,放出11.46KJ的热量,
则生成1mol水时放出的热量为10.2×11.26kJ=56.3kJ,
所以表示中和热的热化学方程式为?KOH(aq)+12H2SO4(aq)=12K2SO4(aq)+H2O△H=-56.3kJ/mol,
故答案为:KOH(aq)+12H2SO4(aq)=12K2SO4(aq)+H2O△H=-56.3kJ/mol;
(2)物质的聚集状态不同,放出的热量不同,水蒸气液化时放热,则有|△H1|<|△H2|,由于氢气的燃烧为放热反应,
△H<0,则△H1>△H2,故答案为:△H1>△H2.
本题解析:
本题难度:一般
5、填空题 由氢气和氧气反应生成1 mol水蒸气放热241.8kJ,写出该反应的热化学方程式:
。
已知H2O(l) = H2O (g) ΔH = +44 kJ·mol-1,则标准状况下33.6 L H2生成液态水时放出的热量是 kJ 。
参考答案:(1)H2(g)+1/2O2(g)===H2O(g);ΔH=-241.8 kJ/mol (2)428.25kJ
本题解析:氢气和氧气反应生成1 mol水蒸气放热241.8kJ,所以该反应的热化学方程式是H2(g)+1/2O2(g)=H2O(g) ΔH=-241.8 kJ/mol。已知H2O(l) = H2O (g) ΔH = +44 kJ/mol,则根据盖斯定律可知,H2(g)+1/2O2(g)=H2O(l) ΔH=-285.8 kJ/mol。标准状况下33.6 L H2的物质的量是1.5mol,所以生成液态水时放出的热量是285.8 kJ/mol×1.5mol=428.25kJ。
考点:考查反应热的计算和热化学方程式的书写
点评:该题是基础性试题的考查,侧重对学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑思维能力和规范的答题能力,难度不大。
本题难度:一般