时间:2019-07-03 23:50:08
1、选择题 已知单位体积的稀溶液中,非挥发性溶质的分子或离子数越多,该溶液的沸点就越高。则下列溶液沸点最高的是
[? ]
A.0.0l mol/L的蔗糖溶液
B.0.0l moI/L的CaCl2溶液
C.0.02 moI/L的NaCl溶液
D.0.02 mol/L的CH3COOH溶液
参考答案:C
本题解析:
本题难度:简单
2、填空题 已知金属离子从开始形成氢氧化物沉淀到沉淀完全时溶液的pH。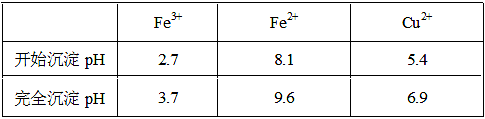
(1)实验室配制FeCl2溶液时需加入少许盐酸和铁粉,若只加盐酸、不加铁粉,溶液中会发生什么变化,用离子方程式表示为:?;
(2)氯化铜晶体(CuCl2·2H2O)中含FeCl2杂质,为制得纯净氯化铜晶体,首先将其制成水溶液,然后按下面所示的操作步骤进行提纯。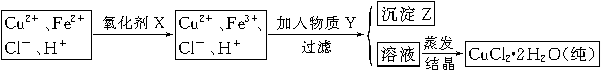
①加氧化剂X的目的是?,下列氧化剂中最适合作氧化剂X的是?(填序号);
A.NaClO
B.H2O2
C.KMnO4
D.HNO3
②物质Y的化学式是?;加入物质Y的目的是调节溶液的pH至a,使Fe3+沉淀完全,则a的范围是?;若25℃时,a=3的溶液中,c(Fe3+)=?mol·L-1。(25℃时,Ksp[Fe(OH)3]=4.0×10-38)
(3)欲将CuCl2·2H2O加热制得无水CuCl2,将采用什么方法和措施?__________。
参考答案:(1)4Fe2++O2+4H+ 4Fe3++2H2O
4Fe3++2H2O
(2)①将Fe2+氧化为Fe3+?B?②CuO[或Cu(OH)2或CuCO3] 3.7≤a<5.4? 4.0×10-5
(3)在HCl气氛下蒸发,以抑制CuCl2水解
本题解析:(1)实验室配制FeCl2溶液时需加入少许盐酸和铁粉,目的是为了防止亚铁离子被氧化和析出沉淀,若只加盐酸、不加铁粉,溶液的亚铁离子被氧化为铁离子,其离子方程式为:4Fe2++O2+4H+ 4Fe3++2H2O;(2)氯化铜晶体(CuCl2·2H2O)中含FeCl2杂质,加氧化剂X的目的是将Fe2+氧化为Fe3+,最适合作氧化剂X的是H2O2,因为其氧化产物无污染,且容易除去;②物质Y是为了调节溶液的pH,并且不能引入新的杂质,或者是杂质很容易就除去了,故Y应该为CuO[或Cu(OH)2或CuCO3],右表可以看出,铁离子在pH为3.7时沉淀完全,而铜离子在5.4时才开始沉淀,故a的范围为3.7≤a<5.4;若25℃时,a=3的溶液中,则c (OH-)=10-11mol/L,c(Fe3+)=4.0×10-38/(10-11)3mol/L= 4.0×10-5 mol/L;(3)欲将CuCl2·2H2O加热制得无水CuCl2,因为其为强酸弱碱盐,所以必须在HCl气氛下蒸发,以抑制CuCl2水解。
4Fe3++2H2O;(2)氯化铜晶体(CuCl2·2H2O)中含FeCl2杂质,加氧化剂X的目的是将Fe2+氧化为Fe3+,最适合作氧化剂X的是H2O2,因为其氧化产物无污染,且容易除去;②物质Y是为了调节溶液的pH,并且不能引入新的杂质,或者是杂质很容易就除去了,故Y应该为CuO[或Cu(OH)2或CuCO3],右表可以看出,铁离子在pH为3.7时沉淀完全,而铜离子在5.4时才开始沉淀,故a的范围为3.7≤a<5.4;若25℃时,a=3的溶液中,则c (OH-)=10-11mol/L,c(Fe3+)=4.0×10-38/(10-11)3mol/L= 4.0×10-5 mol/L;(3)欲将CuCl2·2H2O加热制得无水CuCl2,因为其为强酸弱碱盐,所以必须在HCl气氛下蒸发,以抑制CuCl2水解。
点评:本题考查了盐类水解,溶度积等知识点,这些考点都是高考考查的重点和难点,本题有一定的综合性,关键是要根据表中的数据进行解答,本题难度中等。
本题难度:一般
3、实验题 (9分)某化学兴趣小组在学习了电解质的有关知识后,老师提出了一个“电解质水溶液导电能力的强弱的影响因素”的课题。让该小组来完成课题的研究,已知HCl在水中能完全电离。
(1)该小组同学首先用密度为1.049 g·cm-3的乙酸(CH3COOH)和质量分数为36.5%,密度为1.18 g·cm-3的浓盐酸分别配制1 mol/L CH3COOH溶液和1 mol/L HCl溶液各500 mL,则他们应该量取乙酸和浓盐酸的体积分别为?和?;
(2)某同学在配制500 mL 1 mol/L的CH3COOH溶液时,向容量瓶中转移溶液时操作如图所示,图中的错误有?;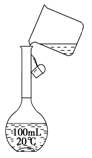
(3)他们首先用下图所示装置测1 mol/L的CH3COOH溶液和1 mol/L HCl溶液的导电能力,接通电源后发现与HCl溶液相连的灯泡较亮,有同学认为乙酸是弱电解质,你?(填“同意”或“不同意”)他的观点,通过该现象你得到的结论是?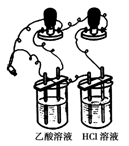
(4)他们又用上述装置测物质的量浓度相同的CuSO4溶液和NaOH溶液的导电能力,接通电源后发现与CuSO4溶液相连的灯泡较亮,有同学认为NaOH是弱电解质,你?(填“同意”或“不同意”)他的观点,通过该现象你得到的结论是?;
(5)通过上述探究实验,你能得到的结论是?
参考答案:(共9分)
(1)28.6 mL(2分)? 42.4 mL(2分)?
(2)未用玻璃棒引流(1分);未采用500 mL容量瓶(来源:91考试网1分)
(3)同意?阴、阳离子带电荷数目相同时,单位体积内自由移动离子数目越大,电解质溶液的导电能力越强(1分)
(4)不同意?当单位体积内自由移动离子数目相同时,阴、阳离子带电荷数目越多,电解质溶液的导电能力越强(1分)
(5)电解质溶液的导电能力是由单位体积内自由移动离子数目和离子所带电荷数目共同决定(1分)
本题解析:本题重点考查了溶液的配制及溶液的导电性的影响因素。
(1)两者均为0.5mol
乙酸:V="0.5×60/1..049=28.6" mL?盐酸:0.5×36.5/(36.5%×1.18)="42.4" mL
其它详见答案
本题难度:一般
4、选择题 常温下pH=1的两种一元酸溶液A和B,分别加水稀释至1000倍,其pH与所加水的体积变化如图所示,则下列结论中正确的是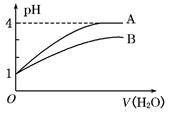
A.A酸比B酸的电离程度小
B.B酸比A酸容易电离
C.A是强碱,B是弱碱
D.pH=1时,B酸的物质的量浓度比A酸大
参考答案:D
本题解析:本题难易程度为中等,根据酸溶液稀释pH变化规律,强酸溶液:pH=a,加水稀释10n倍,则pH=a+n弱酸溶液:pH=a,,加水稀释10n倍,则a<pH<a+n。酸溶液的pH不可能大于7可知A酸为强酸,B为弱酸。所以C选项错误。
A选项错误,强酸为强电解质完全电离,弱酸部分电离。所以A酸比B酸的电离程度大。
B选项错误,强酸比弱酸容易电离。A酸比B酸容易电离.
D选项正确,pH相同时,弱酸的物质的量浓度比强酸大。
本题难度:一般
5、选择题 氢氰酸(HCN)的下列性质中,可以证明它是弱电解质的是( )
A.1mol/L氢氰酸溶液的pH约为3
B.HCN易溶于水
C.10mL 1mol/L?HCN恰好与10mL?1mol/L?NaOH溶液完全反应
D.HCN溶液的导电性比强酸溶液的弱
参考答案:A、氢氰酸为一元酸,1mol/L氢氰酸溶液的pH=0时该酸为强酸,但pH约为3,说明电离生成的氢离子约为10-3mol/L<1mol/L,电离不完全,故A正确;
B、不能利用物质的溶解性来判断是否为弱电解质,即溶解性与电解质的强弱无关,故B错误;
C、10mL1mol/LHCN恰好与10mL1mol/LNaOH溶液完全反应,只能说明HCN为一元酸,不能说明其电离的程度,故C错误;
D、溶液的导电性取决于溶液中的离子浓度大小,与酸性强弱无关,HCN溶液的导电性比强酸溶液的弱,不能说明HCN电离不完全,故D错误;
故选A.
本题解析:
本题难度:简单