时间:2019-07-03 23:27:52
1、简答题 下列叙述中不正确的是( )
A.任一主族元素均由非金属元素和金属元素组成
B.第n周期第n主族的元素可能是金属元素,也可能是非金属元素
C.第n周期有(8-n)种非金属元素(1<n≤7,包括稀有气体)
D.同种元素的不同粒子,它们的电子层数可能不同
参考答案:A.第ⅡA族元素全部为金属元素,没有非金属元素,0族元素全部是非金属元素,故A错误;
B.第n周期第n主族的元素的核外电子层数和最外层电子数相等,可能为H、Be、Al、Ge、Sb、Po等,既有金属,也有非金属,故B正确;
C.根据第二周期有6种非金属元素,第三周期有5种非金属性元素,第四周期有4种非金属元素,第五周期有3种非金属元素,第六周期有2种非金属元素,第七周期应有1种非金属元素,由此可得出第n周期有(8-n)种非金属元素(1<n≤7,包括稀有气体),故C正确;
D.同种元素的原子和简单阳离子的电子层数不同,如Na与Na+,故D正确.
故选A.
本题解析:
本题难度:一般
2、选择题 下表是部分短周期元素的相关信息:
A.沸点:H2Q>H2R
B.碱性:T(OH)3>M(OH)2
C.T和Q两者最高价氧化物对应的水化物可以发生反应
D.L与R形成的化合物中只能含有离子键
参考答案:C
本题解析:试题分析:最高正价等于其主族序数,最高正极和负价代数和为8,可以推知L、M、T分别为第ⅠA、ⅡA、ⅢA族,Q、R为ⅥA族,又因为同周期从做到右半径依次减小,可以确定R为第二周期,其余为第三周期从而确定分别为L是Na, M是Mg, T是Al,R是O,Q是S, A中H2O中有氢键,沸点高,错误;B中NaOH碱性强,错误;C中Al(OH)3和H2SO4反应,正确;D中可以形成Na2O2有离子键和共价键,错误。
考点:考查元素周期律
本题难度:一般
3、填空题 X、Y、Z是主族的三种非金属元素,它们在周期表中的位置如下表所示
试回答:
(1)X元素单质的化学式是________________。
(2)Y元素的原子结构示意图是_______,Y与Na 所形成化合物的电子式为____________。
(3)Z元素的名称是________,从元素原子得失电子的角度看,Z元素具有_______性;若从Z元素在周期表中所处位置看,它具有这种性质的原因是__________。
参考答案:(1)F2
(2)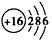 ;
;
(3)砷;两;Z位于元素周期表中金属与非金属交界线附近。
本题解析:
本题难度:一般
4、推断题 短周期元素Q、R、T、W在元素周期表中的位置如下图所示,期中T所处的周期序数与主族序数相等,请回答下列问题: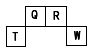
(1)元素的非金属性为(原子的得电子能力):Q ____W(填“强于”或“弱于”)。
(2)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为_____________________________________。
(3)R有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2L的甲气体与0.5L的氯气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐的化学式是_______。
参考答案:(1)弱于
(2)S+2H2SO4(浓) 3SO2↑+2H2O。
3SO2↑+2H2O。
(3) NaNO2
本题解析:
本题难度:一般
5、填空题 下表为元素周期表的一部分,请参照元素①~⑨在表中的位置,用化学用语回答下列问题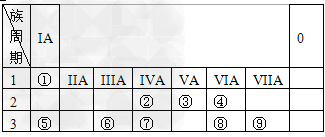
(1)画出⑦的原子结构示意图_________?;写出其单质的一种重要用途_________。
(2)②、⑤、⑥的原子半径由大到小的顺序为___________;⑦、⑧、⑨的最高价含氧酸的酸性由强到弱的顺序是________________。
(3)②的单质与③、⑧的最高价氧化物对应水化物的浓溶液都能发生反应,其反应的化学方程式为__________?;____________。
(4)X、Y是中学化学中的常见物质,X、Y分别由元素④、⑤和②、④形成,X与Y的反应是潜水艇和呼吸面具中氧气的来源。X中含有的化学键类型是_________;Y的电子式是_________;写出X、Y之间反应的化学方程式___________?;当反应中有3.01×1023个电子转移时,参加反应的Y的质量是_____________g。
(5)现有Z、W两种中学化学中的常见物质,它们由①、③、④中的两种或三种元素组成。Z的浓溶液能使蛋白质显黄色,由此可知Z的化学式为__________;W中①、③两种元素的质量比为3:14,请用电子式表示W的形成过程__________;W与④的单质在催化剂、加热条件下发生的反应是工业制取Z的基础,写出该反应的化学方程式_____________。
(6)由表中两种元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)?___________。 a.MnO2?b.FeCl3?c.Na2SO3?d.KMnO4?
参考答案:(1)“略”;用作半导体材料
(2)Na>Al>C;HClO4>H2SO4>H2SiO3
(3)C+2H2SO4 CO2↑+2SO2↑+2H2O;C+4HNO3
CO2↑+2SO2↑+2H2O;C+4HNO3 4NO2↑+CO2↑+H2O
4NO2↑+CO2↑+H2O
(4)离子键、非极性键;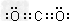 ?;2Na2O2+2CO2=2Na2CO3+O2;22g?
?;2Na2O2+2CO2=2Na2CO3+O2;22g?
(5)HNO3?;“略”;4?NH3?+?5?O2?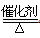 4?NO?+?6?H2O
4?NO?+?6?H2O
(6)a、b
本题解析:
本题难度:一般