时间:2019-07-03 23:27:52
1、选择题 A、B、C、D、E五种主族元素原子序数逐渐增大,且均不超过18,其中A与C、B与E分别为同族元素。原子半径A<B<E<D<C,B原子最外层电子数是次外层的3倍,C、D的核外电子数之和与B、E核外电子数之和相等。下列说法正确的是
[? ]
A.A与E形成的化合物为离子化合物?
B.气态氢化物的稳定性:B<E
C.简单离子半径:E<D?
D.最高价氧化物对应水化物的碱性:C>D
2、选择题 下列有关物质结构的说法,正确的是?
[? ]
3、推断题 A、B、C均为短周期元素,可形成A2C和BC2两种化合物。A、B、C的原子序数依次递增,A原子的K层电子数目只有一个,B位于A的下一周期,它的最外层电子数比K层多2个,而C原子的最外层电子数比次外层电子数少2个。
(1)A、B、C的元素符号分别为A____,B____,C____。
(2)B原子的电子排布式为________。
(3)BC2是由____键组成的____(填“极性”或“非极性”)分子,分子的立体结构为____。
4、推断题 核电荷数由小到大顺序排列的五种短周期元素X、Y、Z、W、Q,其中:在同周期元素中,Z的金属性最强,Q的非金属性最强;W的单质是自然界存在的黄色固体;X、Y、W在周期表中的相对位置关系如图所示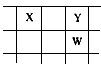
(1)五种元素形成的单质中常用作强氧化剂的是________、________(填化学式)
(2)这五种元素中,原子半径最大的是________(填化学式);由Z、W、Q形成的简单离子半径由大到小的顺序是________(用化学式表示);X、W、Q的最高价氧化物的水化物酸性从强到弱的顺序为________(用化学式表示)。
(3)Y和Z形成的一种化合物中含有离子键和共价键,写出该化合物与水反应的化学方程式________________________。
(4)Z与Q反应生成的化合物属于________化合物;电解该化合物的饱和溶液,阳极的电极反应式为________________;电解一段时间后,将阳极产物和阴极溶液混合,反应的化学方程式是________________。
(5)由X、Y和氢三种元素组成的化合物X6H12Y6,已知:9 g该化合物燃烧生成XY2和液态H2Y时。放出
140 kJ的热量。写出该化合物燃烧热的热化学方程式:________________________。
5、选择题 X、Y是元素周期表ⅦA族中的两种元素.下列叙述能说明X的非金属性比Y强的是( )
A.X原子的电子层数比Y原子的电子层数少
B.Y的单质能将X从NaX的溶液中置换出来
C.X的单质比Y的单质更容易与氢气反应
D.同浓度下X的氢化物水溶液比Y的氢化物水溶液的酸性强