时间:2019-07-03 23:26:09
1、选择题 能促进水的电离,并使溶液中c(H+)>c(OH-)的操作是(?)
①将水加热煮沸?②向水中投入一小块金属钠?③向水中通CO2
④向水中通NH3?⑤向水中加入明矾晶体?⑥向水中加入NaHCO3固体
⑦向水中加NaHSO4固体
A.①③⑥⑦
B.①③⑤⑥
C.⑤⑦
D.⑤
参考答案:D
本题解析:大量吸热,所以升高温度,促进电离,但纯水仍然显中性。钠溶于水生成氢氧化钠,增大OH-的浓度,抑制水的电离。同样③④⑦的水溶液均电离出氢离子或OH-,抑制水的电离。⑤⑥属于盐类的水解,促进电离,其中⑤水解显酸性,⑥水解显碱性,所以答案选D。
本题难度:一般
2、选择题 pH=11的X、Y两种碱溶液各10mL,分别稀释至1000mL。其pH与溶液体积(V)的关系如图所示,下列说法正确的是(?)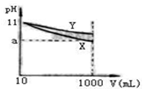
A.X、Y两种碱的物质的量浓度一定相等
B.稀释后,X溶液碱性比Y溶液碱性强
C.若9<a<11,则X、Y都是弱碱
D.完全中和X、Y两溶液时,消耗同浓度盐酸的体积VX>VY
参考答案:C
本题解析:由于稀释可以促进弱电解质的电离,所以对于pH相等的碱溶液,相对弱的碱的pH减小的幅度要小,即酸Y较弱;均稀释到1L时,Y的碱性略强。
由图知两种碱的碱性强弱Y<X,所以pH=11时的两溶液,由c(H+)=c·α公式可知,两碱的物质的量浓度一定不相等;但Y是不是强碱,也不能肯定,如果a=9,则可肯定X为强碱,否则为弱碱
D:由Y的碱性较弱,再由c(H+)=c·α可知Y的c较大,,其物质的量较大,中和时耗盐酸较多
本题难度:一般
3、选择题 关于常温下pH=2的醋酸溶液,下列叙述正确的是
A.c(CH3COOH)=0.01mol·L-1
B.c(H+)=c(CH3COO-)
C.加水稀释100倍后,溶液pH=4
D.醋酸的电离常数为Ka,CH3COO-的水解常数为Kh,则Ka·Kh=Kw
参考答案:D
本题解析:醋酸部分电离,它的起始物质的量浓度比c(H+)大得多,A错;由于水也电离出H+,c(H+)>c(CH3COO-)B错;加水稀释100倍,pH上升不到2个单位,C错。Kh=c(OH-)(CH3COOH)/c(CH3COO-),给表达式上下同乘以c(H+),方可推断出Ka·Kh=Kw。答案选D。
本题难度:一般
4、选择题 下列说法正确的是(?)
A.pH=2和pH=l的硝酸中c(H+)之比为10:1
B.一元酸与一元碱恰好完全反应后的溶液中一定存在c(H+)=c(OH-)
C.KAl(SO4)2溶液中离子浓度的大小顺序为c(SO2-4)>c(K+)>c(Al3+)>c(H+)>c(OH-)
D.常温下,将pH均为12的氨水和NaOH溶液分别加水稀释100倍后,NaOH溶液的pH较大
参考答案:C
本题解析:A:pH=2和pH=l的硝酸中c(H+)之比为1:10,排除
B:酸碱中和后溶液不一定呈中性,c(H+)与c(OH-)不一定相等,不正确
C:由于铝离子部分水解,溶液呈酸性,正确
D:由于弱碱存在电离平衡,在稀释过程中可以促进其电离,故稀释相同倍数后,氨水的pH较大,不正确
答案为C
本题难度:简单
5、实验题 (12分)某学生用0.l000mol.L-l盐酸标准溶液测定某烧碱样品的纯度(杂质不与盐酸反应)。实验步骤如下:
(1)配制待测液:用2.50 g含有少量杂质的固体烧碱样品配制500 mL溶液。需用的玻璃仪器除了烧杯、胶头滴管、玻璃棒外,还需要??。
(2)滴定:
I.用蒸馏水洗涤酸式滴定管,并立即注入盐酸标准溶液至“O”刻度线以上
Ⅱ.固定好滴定管并使滴定管尖嘴充满液体,调节液面至“0”或“O”刻度线以下,并记录读数
Ⅲ.移取20.OOmL待测液注入洁净的锥形瓶中,并加入2滴酚酞试液
Ⅳ.用标准液滴定至终点,记录滴定管液面读数。
①上述滴定步骤中有错误的是(填编号)?,该错误操作会导致测定结果?(填“偏大”、“偏小”或“无影响”)。
②步骤Ⅳ中滴定时眼睛应?:判断滴定终点的现象是?。
③若步骤II中仰视读数,步骤Ⅳ中俯视读数,则会使测定结果?(填“偏大”、“偏小”或“无影响’")。
(3)按正确操作测得有关数据记录如下:
| ? 滴定次数 | ? 待测液体积 | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 20.00 | 0.20 | 20.38 |
| 第二次 | 20.00 | 4.00 | 24.20 |
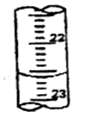
| 第三次 | 20.00 | 2.38 | a |
参考答案:(12分)(1) 500ml容量瓶(1分)? (2)①Ⅰ(2分)?偏大(1分)?
②注视锥形瓶中溶液颜色的变化(1分)?
溶液由红色刚好变为无色,且半分钟内不变色(2分)
③偏小(1分)? (3) ①22.60(2分)?②80.8%(2分)
本题解析:(1) 配制500ml溶液时,需要500ml容量瓶,所以还需要500ml容量瓶。
(2)①滴定管用水洗涤后,还需要用标准液润洗,否则相当于稀释溶液,因此盐酸的浓度降低,消耗的盐酸溶液体积偏大,则测定结果偏高。
②步骤Ⅳ中滴定时眼睛应注视锥形瓶中溶液颜色的变化。由于选择的指示剂是酚酞,所以终点时的现象是溶液由红色刚好变为无色,且半分钟内不变色。
③若步骤II中仰视读数,则读数偏大。步骤Ⅳ中俯视读数,读数偏小,所以消耗溶液的体积偏少,因此测定结果偏小。
(3)根据滴定管的结构可知,此时的读数应该是a=22.60ml。根据表中数据可知,三次实验中消耗盐酸的体积是20.18ml、20.20ml、20.22ml,所以三次实验的平均值是20.20ml,则氢氧化钠的物质的量是0.00202mol,则纯度是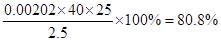 。
。
点评:判断中和滴定中的误差分析的总依据为:由C测==C标V标/V测。由于C标、V待均为定植,所以C测的大小取决于V标的大小,即V标:偏大或偏小,则C测偏大或偏小。根据产生误差的来源,从以下几个方面来分析:①洗涤误差;②读数误差;③气泡误差;④锥形瓶误差;⑤变色误差;⑥样品中含杂质引起的误差等,需要具体问题具体分析。
本题难度:一般