时间:2019-07-03 23:12:58
1、选择题 在化学反应中,下列叙述正确的是
A.反应物的物质的量之和一定等于生成物的物质的量之和
B.反应前各原子的物质的量之和一定等于反应后各原子的物质的量之和
C.溶液稀释前溶质的物质的量一定等于溶液稀释后溶质的物质的量
D.在同温、同压下,反应前气体体积之和一定等于反应后气体体积之和
参考答案:BC
本题解析:略
本题难度:一般
2、选择题 顺式Pt(NH3)2Cl2(相对分子质量为300)是临床广泛使用的抗肿瘤药物.下列有关该物质的说法中正确的是( )
A.由4种元素组成
B.含有NH3分子
C.Pt的化合价为+4
D.Pt元素的质量分数为65%
参考答案:AD
本题解析:
本题难度:简单
3、选择题 铅笔芯的主要成分是石墨和黏土,这些物质按照不同的比例加以混和、压制,就可以制成铅笔芯。如果铅笔芯质量的一半成分是石墨,且用铅笔写一个字消耗的质量约为0.5mg。那么一个铅笔字含有的碳原子数约为(?)
A.2.5×1019个
B.2.5×1022个
C.1.25×1019个
D.1.25×1022个
参考答案:C
本题解析:用铅笔写一个字消耗的质量约为0.5mg,也就是写一个字消耗石墨的质量是 0.25mg=2.5*10-4 g
物质的量是2.5x10-4/12 mol?因此含有的碳原子数目是 N="nx" NA=2.5*10-4/12? *6.02*1023,?故选C。
本题难度:一般
4、选择题 配制100mL 1mol/LNaOH溶液,下列操作中正确的是
[? ]
A.在托盘天平两托盘上各放一片相同的纸,然后将NaOH放在纸片上进行称量
B.配制溶液时,若加水超过容量瓶刻度,应用胶头滴管将多余溶液吸出
C.用蒸馏水洗涤烧杯、玻璃棒2--3次,洗涤液也移入容量瓶中
D.沿着玻璃棒往容量瓶中加入蒸馏水,直到溶液凹面恰好与刻度相切
参考答案:C
本题解析:
本题难度:简单
5、计算题 (11分)一定质量的镁、铝混合物投到2 mol·L-1的盐酸中,待金属完全溶解后,向溶液中加入2 mol·L-1的氢氧化钠溶液,生成沉淀的质量与加入氢氧化钠溶液的体积关系如图所示。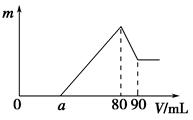
则:
(1)80~90ml对应反应的离子方程式 。
(2)金属铝的质量为______ _
(3)盐酸的体积是 ml。
(4)a的取值范围是___ __。
(5)n(Mg)/n(Al)的最大值是 。
参考答案:(1)Al(OH)3+ OH-=AlO2-+2H2O (2)0.54g(3)80(4)0<a<50 (5)2.5
本题解析:从开始到沉淀量最大的过程中,涉及的反应有Mg+2H+=Mg2++H2↑、2Al+6H+=2Al3++3H2↑、根据图像0-a无沉淀产生,证明盐酸过量反应:H++OH-=H2O、Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓。(1)80 mL~90 mL的NaOH溶液用于溶解Al(OH)3:Al(OH)3+OH-=AlO2-+2H2O;(2)80mL~90mL的NaOH溶液用于溶解Al(OH)3,n(Al)=n(Al(OH)3)=n(NaOH)=0.02mol,金属铝的质量为0.02mol×54g/mol=0.54g;(3)到沉淀最大时消耗的NaOH的物质的量等于HCl的总物质的量,所以盐酸的体积是80ml;(4)形成Al(OH)3沉淀消耗NaOH溶液的体积是30 mL,镁离子沉淀还消耗氢氧化钠,所以a<50,而a≠0,所以0<a<50;(5)沉淀Al3+需要的OH-为0.06mol,即NaOH溶液的体积为30mL,镁离子和铝离子沉淀完全消耗的碱的体积为80-a,若假设盐酸不剩,所以沉淀Mg2+需要NaOH溶液的体积最大值为50mL,求出n (Mg)的最大值为0.05mol,所以该合金中镁铝两元素物质的量之比的最大值为2.5。
考点:考查镁铝及其重要化合物的性质。
本题难度:一般