时间:2019-07-03 23:12:58
1、选择题 4g NaOH溶于水配成50mL溶液,溶液的物质的量浓度是
A.2mol/L
B.0.2 mol/L
C.1 mol/L
D.0.1 mol/L
参考答案:A
本题解析:因为n=m/M,所以4g氢氧化钠是0.1mol。又因为c=n/V,所以溶液的浓度是0.1mol÷0.05L=2mol/L,答案选A。
本题难度:一般
2、填空题 生态农业涉及农家肥料的综合利用,某种肥料经发酵得到一种含甲烷、CO2、氮气的混合气体2.016升(标准状况),该气体通过盛有红热CuO粉末的硬质玻璃管,发生反应:CH4+4CuO CO2+2H2O+4Cu。当CH4完全反应后,硬质玻璃管的质量减轻4.8克。将该反应后产生的气体通过过量澄清石灰水中,充分吸收,生成沉淀8.5克。
CO2+2H2O+4Cu。当CH4完全反应后,硬质玻璃管的质量减轻4.8克。将该反应后产生的气体通过过量澄清石灰水中,充分吸收,生成沉淀8.5克。
(1)原混合气体中CH4的物质的量为________mol;
(2)原混合气体中N2的体积分数为________。
参考答案:(1)0.075;(2)5.56%?(5/90)
本题解析:(1)根据题意,硬质玻璃管质量减轻4.8 g为CuO转化为Cu时,失去O的质量,由CH4+4CuO CO2+2H2O+4Cu得关系式:CH4——4O,又n(O)="4.8" g÷16 g?mol-1="0.3" mol,则n(CH4)="0.075" mol;(2)根据题意,发生的反应为CH4+4CuO
CO2+2H2O+4Cu得关系式:CH4——4O,又n(O)="4.8" g÷16 g?mol-1="0.3" mol,则n(CH4)="0.075" mol;(2)根据题意,发生的反应为CH4+4CuO CO2+2H2O+4Cu ,CO2+Ca(OH)2(过量)=CaCO3↓+H2O,由方程式可得各物质的物质的量关系:n(CaCO3)= n反应后(CO2)=n反应前(CH4+CO2),n(CaCO3)="8.5" g÷100 g?mol-1="0.085" mol,原混合气体的物质的量为:2.016 L÷22.4 L?mol-1=0.09mol,则n(N2)="0.005" mol,所以原混合气体中N2的体积分数为(0.005 mol÷0.09 mol)×100%=5.56%。
CO2+2H2O+4Cu ,CO2+Ca(OH)2(过量)=CaCO3↓+H2O,由方程式可得各物质的物质的量关系:n(CaCO3)= n反应后(CO2)=n反应前(CH4+CO2),n(CaCO3)="8.5" g÷100 g?mol-1="0.085" mol,原混合气体的物质的量为:2.016 L÷22.4 L?mol-1=0.09mol,则n(N2)="0.005" mol,所以原混合气体中N2的体积分数为(0.005 mol÷0.09 mol)×100%=5.56%。
本题难度:一般
3、选择题 0.1mol/L的NH4Cl溶液中,离子浓度大小排列正确的是
A.c(Cl-)> c(NH4+)> c(OH-)> c(H+)
B.c(NH4+)> c(Cl-)> c(OH-)> c(H+)
C.c(Cl-)> c(NH4+)> c(H+)> c(OH-)
D.c(NH4+)> c(Cl-)> c(H+)> c(OH-)
参考答案:C
本题解析:NH4Cl溶液中的部分水解:c(Cl-)> c(NH4+),且两离子为主要离子,溶解呈酸性, c(H+)> c(OH-),故C正确
本题难度:简单
4、选择题 同温同压下,甲容器充满35Cl2,乙容器中充满37Cl2,下列叙述不正确的是
A.若两种气体体积相等,甲、乙两容器中气体的密度之比为35∶37
B.若两种气体体积相等,甲、乙两容器中气体分子数之比为35∶37
C.若两种气体质量相等,甲、乙两容器中气体所含质子数之比为37∶35
D.若两种气体体积相等,甲、乙两容器中气体所含中子数之比为9∶10
参考答案:B
本题解析:根据阿伏加德罗定律可知,在相同条件下,气体的密度之比是相应的摩尔质量之比的反比,A正确;在相同条件下,气体的体积之比是气体的分子数之比,B不正确;两种氯气的相对分子质量之比是70︰74,所以在质量相等的条件下,两种氯气的物质的量之比是37∶35,则质子数之比也是37∶35,C正确;两种氯气的中子数之比是(35-17)×2/(37-17)×2=9∶10。所以若两种气体体积相等,甲、乙两容器中气体所含中子数之比为9∶10,D正确,答案选B。
点评:同温同压下,相同体积的任何气体含有相同的分子数,称为阿伏加德罗定律,又叫四同定律,也叫五同定律(五同指同温、同压、同体积、同分子个数、同物质的量)。其推论有(1)同温同压下,V1/V2=n1/n2(2)同温同体积时,P1/P2=n1/n2=N1/N2(3)同温同压等质量时,V1/V2=M2/M1(4)同温同压时,M1/M2=ρ1/ρ2。
本题难度:一般
5、选择题 已知钾的氧化物有K2O2和KO2,在两种化合物组成的混合物中,钾与氧的质量比为13∶8,求混合物中K2O2与KO2的物质的量之比。
参考答案:混合物中K2O2与KO2的物质的量之比为1∶2。
本题解析:设混合物中K2O2与KO2的物质的量之比为x∶y,由K2O2、KO2组成可知:
n(K)∶n(O)=(2x+y)∶(2x+2y)
m(K)∶m(O)="39" g·mol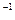 ×(2x+y)∶[16 g·mol
×(2x+y)∶[16 g·mol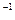 ×(2x+2y)]=13∶8
×(2x+2y)]=13∶8
求得x∶y=1∶2。
本题难度:简单