时间:2019-07-03 23:12:58
1、计算题 (1). (2分)在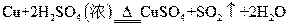 反应中,若有3.2 g的Cu参与反应,则被还原的H2SO4的物质的量是?mol.
反应中,若有3.2 g的Cu参与反应,则被还原的H2SO4的物质的量是?mol.
(2). (6分右图是我校化学实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。计算:(要求写出简要计算过程)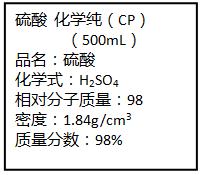
①求该浓硫酸的物质的量浓度?
②用该浓硫酸配制200mL1mol/L的稀硫酸,]量筒所需量取该浓硫酸的体积是多少mL?
参考答案:(共8分)
(1) (2分)0.05 mol
(2) (6分)?①? 18.4 mol/L? (给出公式1分,全对3分)
②? 10.9 mL? (给出公式1分,保留到小数点后两位的扣1分,全对3分)
本题解析:略
本题难度:一般
2、选择题 设NA为阿伏加德罗常数的值。下列说法正确的是
A.0.1 mol羟基( )中含有的电子数为0.7 NA
)中含有的电子数为0.7 NA
B.1 L 0.1 mol·L-1的AlCl3溶液中含有Al3+的数目为0.1 NA
C.0.1 mol N2与足量H2反应,转移的电子数为0.6 NA
D.标准状况下,1.12 L HCHO中C原子的数目为0.05 NA
参考答案:B
本题解析:A中0.1 mol羟基( )中含有的电子数为0.9 NA,错误;B中Al3+会发生水解,数目肯定小于0.1 NA,错误;C.N2和H2的反应是可逆反应,反应物不能完全转化,转移的电子数小于0.6 NA,错误;D.标准状况下,1.12 L HCHO物质的量是0.05mol,其中C原子的数目为0.05 NA,正确。
)中含有的电子数为0.9 NA,错误;B中Al3+会发生水解,数目肯定小于0.1 NA,错误;C.N2和H2的反应是可逆反应,反应物不能完全转化,转移的电子数小于0.6 NA,错误;D.标准状况下,1.12 L HCHO物质的量是0.05mol,其中C原子的数目为0.05 NA,正确。
本题难度:一般
3、选择题 将153.5g由氯化钠和氯化镁混合而成的盐溶解于水配成1L溶液,测得溶液中Cl-的浓度为3mol/L,则溶液中Na+的物质的量浓度为( )
A.2mol/L
B.1mol/L
C.0.5mol/L
D.0.1mol/L
参考答案:设氯化钠的物质的量为xmol,氯化镁的物质的量为ymol,溶液中含有的氯离子的物质的量为:3mol/L×1L=3mol,
根据混合物质量和氯离子的物质的量列式为:
本题解析:
本题难度:简单
4、填空题 实验需498mL0.200mol/L的CuSO4溶液,实验室用胆矾晶体配制溶液,请填写下列空白:
(1)需称取胆矾晶体______g;
(2)本实验用到的基本仪器已有烧杯、天平(砝码、镊子)、药匙,还缺少的仪器是______、______、______;
(3)下列情况会使所配溶液浓度偏低的是(填序号)______.
a.定容时俯视b.未洗涤烧杯
c.加蒸馏水时,不慎超过了刻度线
d.称量时物品和砝码位置放反(1g以下用游码)
e.将胆矾改成16.0g无水CuSO4配制.
参考答案:(1)实验需498mL 0.200mol/L的CuSO4溶液,实验室没有498mL容量瓶,应该选用500mL容量瓶,实际配制的是500mL 0.200mol/L的CuSO4溶液,需要硫酸铜的物质的量为:0.200mol/L×0.5L=0.1mol,需要硫酸铜晶体的质量为:250g/mol×0.1mol=25.0g,
故答案为:25.0g;
(2)配制的是500mL 0.200mol/L的CuSO4溶液,一般用天平称量,用药匙取药品,在烧杯中溶解,用玻璃棒搅拌,冷却后转移到500mL容量瓶中,并用玻璃棒引流,转移完毕,用少量蒸馏水洗涤烧杯及玻璃棒2~3次并将洗涤液全部转移到容量瓶中,再加适量蒸馏水,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,使溶液的凹液面的最低点与刻线相平,塞好瓶塞,反复上下颠倒摇匀.所以需要的仪器为:天平、药匙、胶头滴管、烧杯、玻璃棒、500mL容量瓶,所以还缺少的仪器为:500mL容量瓶、玻璃棒、胶头滴管,
故答案为:500mL容量瓶;玻璃棒;胶头滴管;
(3)a.定容时俯视,导致加入的蒸馏水体积偏小,根据c=nV可得,配制的溶液浓度偏高,故a错误;
b.未洗涤烧杯,导致配制的溶液中溶质的物质的量偏小,根据c=nV可得,配制的溶液浓度偏低,故b正确;
c.加蒸馏水时,不慎超过了刻度线,导致配制的溶液体积偏大,根据c=nV可得,配制的溶液浓度偏低,故c正确;
d.称量时物品和砝码位置放反(1g以下用游码),导致称量的溶质的质量偏小,配制的溶液中溶质的物质的量偏小,根据c=nV可得,配制的溶液浓度偏小,故d正确;
e.将胆矾改成16.0g无水CuSO4配制,溶质的物质的量不变,根据c=nV可得,配制的溶液浓度不变,故e错误;
故选bcd.
本题解析:
本题难度:一般
5、选择题 用NA表示阿伏加德罗常数,下列说法正确的是
A.常温常压下,1mol乙烯共用电子对数为4NA
B.1mol乙醛与足量新制Cu(OH)2悬浊液反应,转移电子数目为NA
C.标准状况下,NA个HF分子的体积约为22.4L
D.0.1mol乙烯和乙醇的混合物完全燃烧所消耗的氧原子数一定为0.6 NA
参考答案:D
本题解析:A.常温常压下,1mol乙烯共用电子对数为5NA,错误;B.1mol乙醛与足量新制Cu(OH)2悬浊液反应,转移电子数目为2NA,错误;C.标准状况下,NA个HF分子的分子之间存在氢键,使分子之间的距离变小,所以体积小于22.4L,错误;D.由于每1mol的乙烯或乙醇消耗的氧气的物质的量是3mol,所以0.1mol乙烯和乙醇的混合物完全燃烧所消耗的氧原子数一定为0.6 NA,正确。
考点:考查阿伏加德罗常数的有关计算的知识。
本题难度:一般