时间:2019-07-03 23:08:53
1、选择题 欲使0.1mol/L的NaHCO3溶液中c(H+)、c(CO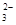 )、c(HCO3?)都减少,其方法是(?)
)、c(HCO3?)都减少,其方法是(?)
A.加入氢氧化钠固体
B.加水
C.通入二氧化碳气体
D.加入饱和石灰水溶液
参考答案:D
本题解析:略
本题难度:一般
2、填空题 普通泡沫灭火器的铁筒里装着一只小玻璃筒,玻璃筒内盛装硫酸铝溶液,铁筒里盛装碳酸氢钠饱和溶液。使用时,倒置灭火器,两种药液相混合就会喷出含二氧化碳的白色泡沫。
(1)产生此现象的离子方程式是____________________________。
(2)不能把硫酸铝溶液装在铁筒里的主要原因是__________? ___。
(3)一般不用碳酸钠代替碳酸氢钠,是因为____________________________。
参考答案:(1)Al3+与HCO3—发生双水解反应。 Al3++3HCO3—===Al(OH)3↓+3CO2↑
(2)Al2(SO4)3溶液因水解呈酸性,会腐蚀铁筒,Al3++3H2O  ?Al(OH)3+3H+
?Al(OH)3+3H+
(3)与酸反应速率NaHCO3>Na2CO3;产生等量CO2时,消耗Al3+量:Na2CO3>NaHCO3;等质量的Na2CO3、NaHCO3分别与足量Al3+反应,生成CO2量NaHCO3>Na2CO3
本题解析:略
本题难度:一般
3、选择题 现有0.4 mol·L-1HA溶液和0.2 mol·L-1NaOH溶液等体积混合组成的混合溶液。下列有关推断正确的是(? )
A.若该溶液中HA的电离能力大于A-的水解能力,则有c(Na+)>c(A-)> c(HA)> c(H+)>c(OH-)
B.若该溶液中A-的水解能力大于HA的电离能力,则有c(A-)>c(HA)>c(Na+)> c(OH-)>c(H+)
C.无论该溶液呈酸性还是碱性,都有c(Na+)+c(H+)=c(A-)+c(OH-)
D.无论该溶液呈酸性还是碱性,都有c(Na+)=c(A-)+c(HA)
参考答案:C
本题解析:依题意知,混合溶液中c(HA)="0.1" mol·L-1,c(NaA)="0.1" mol·L-1。A项,若HA的电离能力大于A-的水解能力:HA H++A-(主要),A-+H2O
H++A-(主要),A-+H2O HA+OH-(次要),则溶液呈酸性:c(H+)>c(OH-)。由电荷守恒知,c(H+)+c(Na+)=c(OH-)+c(A-),c(Na+)<c(A-),由于弱电解质的电离程度一般很小,故c(A-)>c(Na+)>c(HA)> c(H+)>c(OH-),A项错误;B项,HA
HA+OH-(次要),则溶液呈酸性:c(H+)>c(OH-)。由电荷守恒知,c(H+)+c(Na+)=c(OH-)+c(A-),c(Na+)<c(A-),由于弱电解质的电离程度一般很小,故c(A-)>c(Na+)>c(HA)> c(H+)>c(OH-),A项错误;B项,HA H++A-(次要),A-+H2O
H++A-(次要),A-+H2O HA+OH-(主要),溶液呈碱性:c(OH-)>c(H+),根据电荷守恒知,c(Na+)>c(A-),由于弱酸根离子的水解程度一般都很小,所以,有c(HA)>c(Na+)>c(A-)>c(OH-)>c(H+),B项错误;C项,由溶液组成知,溶液中只存在H+、Na+、A-、OH-四种离子,由电荷守恒知,c(Na+)+c(H+)=c(OH-)+c(A-),C项正确;D项,根据物料守恒:c(HA)+c(A-)=2c(Na+),D项错误。
HA+OH-(主要),溶液呈碱性:c(OH-)>c(H+),根据电荷守恒知,c(Na+)>c(A-),由于弱酸根离子的水解程度一般都很小,所以,有c(HA)>c(Na+)>c(A-)>c(OH-)>c(H+),B项错误;C项,由溶液组成知,溶液中只存在H+、Na+、A-、OH-四种离子,由电荷守恒知,c(Na+)+c(H+)=c(OH-)+c(A-),C项正确;D项,根据物料守恒:c(HA)+c(A-)=2c(Na+),D项错误。
本题难度:一般
4、选择题 欲同时对农作物施用含N、P、K三种元素的化肥,现有:①K2CO3、②KCl、③Ca(H2PO4)2、④(NH4)2SO4、⑤氨水,最适合的组合是( )。
A.①②③
B.②③④
C.①③⑤
D.②③⑤
参考答案:B
本题解析:K2CO3、氨水显碱性,Ca(H2PO4)2、(NH4)2SO4水溶液显酸性,不能混用。
本题难度:一般
5、选择题 下列溶液中各微粒浓度关系判定不正确的是
A.10mL 0.2 mol·L-1的氨水与l0mL 0.1 mol·L-1的盐酸充分反应混合后的溶液中,存在c(NH4+)+c(NH3·H2O)=2c(Cl-)= 0.1 mol·L-1
B.已知酸性HF > CH3COOH,物质的量浓度相等的NaF与CH3COOK溶液中:c(Na+) - c(F-) >c(K+) - c(CH3COO-)
C.CH3COOK溶液中加入少量NaNO3固体后的碱性溶液一定有:c(K+)+c(H+)=c(CH3COO-)+c(OH-)
D.已知NaHS03溶液pH<7,该溶液中一定有:c(Na+)> c(HSO3-)> c(SO32-)>c(H2SO3)
参考答案:B
本题解析:A. n(Cl-)=c·V=0.1mol/L×0.01L=0.001mol.在反应的过程中没有消耗。反应后c(Cl-)="n/L" ="0.001mol" ÷0.02L="0.05mol/L." n(NH3)= c·V=0.1mol/L×0.02L=0.002mol.反应后 n(NH3) ="n/L=0.002mol" ÷0.02L=" 0.1" mol/L根据物料守恒可得c(NH3)= c(NH4+)+c(NH3·H2O)= 0.1mol/L="2" c(Cl-).正确。B. HF、CH3COOH都是弱酸,所以NaF与CH3COOK都是强碱弱酸盐。由于酸性HF > CH3COOH,所以根据盐的水解规律:有弱才水解,越弱越水解,谁强显谁性。水解程度CH3COO->F-。n(NaF)=n(CH3COOK).水解程度越大,剩余离子的浓度就越小。所以c(K+) ?—c(CH3COO-) >c(Na+) —c(F-)。错误。C. 在任何溶液中都存在着电荷守恒。即阳离子所带的正电荷总数与阴离子所带的负电荷总数相等。可得c(Na+)+c(K+)+c(H+)=c(CH3COO-)+c(OH-)+ c(NO3-)。由于NaNO3是强酸强碱盐,在溶液中不水解,所以c(Na+)=c(NO3-)。两式相减可得:c(K+)+c(H+)=c(CH3COO-)+c(OH-)。正确。D. NaHSO3是强碱弱酸的酸式盐。在溶液中存在电离平衡HSO3-- H++ SO32--,和水解平衡:HSO3+H2O--
H++ SO32--,和水解平衡:HSO3+H2O-- OH-+H2SO3。电离使溶液显酸性,水解使溶液显碱性。由于NaHSO3溶液pH<7,说明电离>水解。c(SO32-)>c(H2SO3).则根据物料守恒可得:c(Na+)= c(HSO3-) +c(SO32-)+ c(H2SO3)。由于c(HSO3-)的电离和水解消耗,所以c(Na+)> c(HSO3-)。因此在该溶液中一定有:c(Na+)> c(HSO3-)> c(SO32-) >c(H2SO3)。正确。
OH-+H2SO3。电离使溶液显酸性,水解使溶液显碱性。由于NaHSO3溶液pH<7,说明电离>水解。c(SO32-)>c(H2SO3).则根据物料守恒可得:c(Na+)= c(HSO3-) +c(SO32-)+ c(H2SO3)。由于c(HSO3-)的电离和水解消耗,所以c(Na+)> c(HSO3-)。因此在该溶液中一定有:c(Na+)> c(HSO3-)> c(SO32-) >c(H2SO3)。正确。
本题难度:一般