时间:2019-07-03 23:08:53
1、选择题 下列叙述中,正确的是
A.0.1 mol?L-1 CH3COOH溶液加水稀释时,所有离子的浓度都减小
B.NH4Cl溶液显酸性的原因:NH4+ + H2O  NH3·H2O + H+
NH3·H2O + H+
C.0.2 mol?L-1盐酸与等体积0.05 mol?L-1 Ba(OH)2溶液混合后,溶液pH为1
D.25℃时pH=3的醋酸溶液与pH=11的氢氧化钠溶液等体积混合后pH=7
参考答案:B
本题解析:略
本题难度:一般
2、选择题 下列有关物质浓度关系的描述,正确的是? ( )。
A.25 ℃时,NaB溶液的pH=8,c(Na+)-c(B-)=9.9×10-7mol·L-1
B.25 ℃时,向0.1 mol·L-1NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(NH4+)>c(SO42—)>c(OH-)=c(H+)
C.0.1 mol·L-1NaHCO3溶液中:c(OH-)+2c(CO32—)=c(H+)+c(H2CO3)
D.同温下,pH相同时,溶液物质的量浓度:c(CH3COONa)>c(NaHCO3)>c(C6H5ONa)>c(Na2CO3)
参考答案:AD
本题解析:25 ℃时,NaB溶液中根据电荷守恒可得:c(Na+)+c(H+)=c(B-)+c(OH-),则c(Na+)-c(B-)=c(OH-)-c(H+),根据NaB溶液的pH=8,则pOH=6,故c(Na+)-c(B-)=c(OH-)-c(H+)=1×10-6mol·L-1-1×10-8mol·L-1=9.9×10-7mol·L-1,A正确;向0.1 mol·L-1NH4HSO4溶液中滴加NaOH溶液,首先发生的反应是2NH4HSO4+2NaOH===(NH4)2SO4+Na2SO4+2H2O,此时c(SO42—)=c(NH4+),但因为(NH4)2SO4是强酸弱碱盐,溶液呈酸性,若欲使溶液呈中性,则少量(NH4)2SO4继续与NaOH反应生成NH3·H2O,所以离子浓度关系应为c(Na+)>c(SO42—)>c(NH4+)>c(OH-)=c(H+),B错误;0.1 mol·L-1的NaHCO3溶液中,电荷守恒式为c(OH-)+2c(CO32—)+c(HCO3—)=c(H+)+c(Na+),物料守恒式为c(Na+)=c(CO32—)+c(HCO3—)+c(H2CO3),所以c(OH-)+c(CO32—)=c(H+)+c(H2CO3),C错误;因为酸性:CH3COOH>H2CO3>C6H5OH>HCO3—,则它们对应盐的水解程度c(CH3COONa)<c(NaHCO3)<c(C6H5ONa)<c(Na2CO3),所以同温下,pH相同时,溶液物质的量浓度:c(CH3COONa)>c(NaHCO3)>c(C6H5ONa)>c(Na2CO3),D正确。
本题难度:一般
3、选择题 对100mL 1mol·L-1的Na2CO3溶液,下列说法不正确的是
A.将溶液稀释,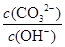 减少
减少
B.滴人含0.l mol CH3COOH的溶液:c ( CH3 COO一)<c( HCO3一)
C.通人0.1 mo1CO2气体,溶液中存在:c ( Na+)=c( CO32一)十c( HCO3一)+c(H2CO3)
D.滴人酚酞,微热,溶液颜色加深
参考答案:B
本题解析:A、碳酸钠溶液中CO32-水解,稀释促进水解,因此CO32-的物质的量减少和OH-的物质的量增加,所以将溶液稀释,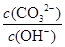 减少,A正确;B、滴人含0.l mol CH3COOH的溶液中二者反应恰好生成碳酸氢钠和醋酸钠,由于醋酸的酸性强于碳酸的,因此醋酸钠的水解程度小于碳酸氢钠的水解程度,所以溶液中c ( CH3 COO一)>c( HCO3一),B不正确;C、通人0.1 mo1CO2气体,二者恰好反应生成碳酸氢钠,根据物料守恒可知溶液中存在:c ( Na+)=c( CO32一)十c( HCO3一)+c(H2CO3),C正确;D、水解吸热,滴人酚酞,微热,促进水解,溶液碱性增强,因此溶液颜色加深,D正确,答案选B。
减少,A正确;B、滴人含0.l mol CH3COOH的溶液中二者反应恰好生成碳酸氢钠和醋酸钠,由于醋酸的酸性强于碳酸的,因此醋酸钠的水解程度小于碳酸氢钠的水解程度,所以溶液中c ( CH3 COO一)>c( HCO3一),B不正确;C、通人0.1 mo1CO2气体,二者恰好反应生成碳酸氢钠,根据物料守恒可知溶液中存在:c ( Na+)=c( CO32一)十c( HCO3一)+c(H2CO3),C正确;D、水解吸热,滴人酚酞,微热,促进水解,溶液碱性增强,因此溶液颜色加深,D正确,答案选B。
本题难度:一般
4、选择题 电解质溶液有许多奇妙之处,你只有深入思考,才能体会到它的乐趣。下列关于电解质溶液的叙述中正确的是
A.Na2CO3、NaHCO3两种盐溶液中,离子种类不相同
B.常温下,1mol/L的CH3COOH溶液与1mol/L的NaOH溶液等体积混合,所得混合液中:c(Na+) >c(CH3COO-) >c(H+)>c(OH-)
C.物质的量浓度相同的NH4Cl和NH4HSO4两种溶液中,c(NH4+)前者小于后者
D.常温下,某溶液中有水电离出的c(H+)=10-51mol·L-1,则此溶液可能是盐酸
参考答案:C
本题解析:A、的Na2CO3、NaHCO3两种盐溶液,阴离子都是 CO32-,HCO3-,OH-,故A错误;B、1 mol?L-1的CH3COOH溶液与1 mol?L-1的NaOH溶液混合,等体积混合,溶液呈碱性,故B错误;C、NH4HSO4溶液中,H+抑制NH4+水解,故C正确;D、常温下,水的离子积为10-14,水电离出的c(H+)=c(OH-)=10-7,酸或碱的溶液抑制水的电离,该溶液中c(H+)=10-5mol?L-1,水的电离程度程度,则此溶液不可能是盐酸,可能是强酸弱碱盐,故D错误.
本题难度:一般
5、填空题 (12分)在常温下,下列三种溶液:①0.1mol/L NH4Cl?②0.1mol/L CH3COONH4?③0.1mol/L NH4HSO4?
请根据要求填写下列空白:
(1)溶液①呈??性(填“酸”、“碱”或“中”),其原因是:
?(用离子方程式表示)
(2)在上述三种溶液中,pH最小的是?;c(NH4+)最小的是??﹝填序号﹞
(3)常温下,测得溶液②的pH=7,则说明CH3COO-的水解程度________(填“>”、“<”或“=”)NH4+的水解程度,CH3COO-与NH4+浓度的大小关系是:
c(CH3COO-) ??c(NH4+)(填“>”、“<”或“=”)
参考答案:(12分)(每空2分)
(1)?酸? NH4++H2O NH3·H2O+H+
NH3·H2O+H+
(2)?③?②
(3)? ="?" =
本题解析:略
本题难度:一般