时间:2019-07-03 23:07:11
1、简答题 由铜片、锌片和50mlCuSO4溶液组成的原电池工作一段时间后,铜片的质量增加了6.4g,且溶液恰好由蓝色变为无色,假设锌片上没有铜单质析出,试计算:
(1)锌片质量减少了______g;
(2)在此过程中通过外电路的电子的物质的量为______;
(3)原CuSO4溶液的物质的量浓度为______.
参考答案:(1)电池反应式为:Cu2++Zn=Zn2++Cu,设参加反应锌的质量为x
Cu2++Zn=Zn2++Cu
65g 64g
x6.4g
65g:64g=x:6.4g
x=65g×6.4g64g=6.5g,
故答案为:6.5;
(2)设转移电子的物质的量为y,
Cu2++Zn=Zn2++Cu 转移电子
64g 2mol
6.4g y
64g:2mol=6.4g:y
y=6.4g×2mol64g=0.2mol,
故答案为:0.2mol;
(3)根据铜原子守恒得n(Cu)=n(CuSO4)=6.4g64g/mol=0.1mol,
所以C(CuSO4)=0.1mol0.05L=2mol/L,
故答案为:2mol/L.
本题解析:
本题难度:一般
2、填空题 (14分)催化剂是化工技术的核心,绝大多数的化工生产均需采用催化工艺。
⑴人们常用催化剂来选择反应进行的方向。下图所示为一定条件下1mol CH3OH与O2发生反应时,生成CO、CO2或HCHO的能量变化图[反应物O2(g)和生成物H2O(g)略去]。在有催化剂作用下,CH3OH与O2反应主要生成 (填“CO、CO2或HCHO”)。
②2HCHO(g)+O2(g)=2CO(g)+2H2O(g)
△H= 。
③在稀硫酸催化下,HCHO可以通过反应生成分子式为C3H6O3的环状三聚甲醛分子,其分子中同种原子的化学环境均相同。写出三聚甲醛的结构简式: 。
④甲醇制取甲醛可用Ag作催化剂,含有AgCl会影响Ag催化剂的活性,用氨水可以溶解除去其中的AgCl,写出该反应的离子方程式: 。
⑵一种以铜作催化剂脱硫有如下两个过程:
①在铜的作用下完成工业尾气中SO2的部分催化氧化,所发生反应为:
2SO2+2n Cu+(n+1)O2+(2-2 n) H2O=2n CuSO4+(2-2n) H2SO4
从环境保护的角度看,催化脱硫的意义为 ;每吸收标准状况下11.2L SO2,被SO2还原的O2的质量为
g。
②利用下图所示电化学装置吸收另一部分SO2,并完成Cu的再生。写出装置内所发生反应的离子方程式 。
参考答案:⑴①HCHO ;②-470kJ·mol-1;③ ;
;
④AgCl+2NH3·H2O=Ag(NH3)2++Cl-+2H2O或AgCl+2NH3=Ag(NH3)2++Cl-
⑵①防止酸雨的发生 ;8;②SO2+2H2O+Cu2+ 4H++SO42
4H++SO42
本题解析:
本题难度:一般
3、填空题 (12分)如下图,通电5 min后,电极5质量增加2.16 g,回答:
(1)电源:a是________极,b是________极;A池电极反应,电极1:__________;
电极2:____________________________________________________________。
C池电极反应,电极5:________________________________________________;
电极6:______________________________________________________________。
(2)如果B池中共收集到224 mL气体(标准状况),且溶液体积为200 mL(设电解过程中溶液体积不变),则通电前溶液中Cu2+的物质的量浓度为________。
参考答案:(1)负 正 2H++2e-===H2↑ 2Cl--2e-===Cl2↑ 2Ag++2e-===2Ag Cu-2e-===Cu2+
(2)0.025 mol/L
本题解析:(1)通电5 min后,电极5质量增加2.16 g,这说明电极5是阴极,所以电极是阳极。则b是电源的正极,a是电源的负极。因此电极1是阴极,氢离子放电生成氢气,电极反应式是2H++2e-===H2↑。电极2是阳极,溶液中的氯离子放电生成氯气,电极反应式是2Cl--2e-===Cl2↑。C装置中电极5是阴极,溶液中的银离子放电,电极反应式是2Ag++2e-===2Ag。电极6是阳极,但电极是铜电极,所以铜失去电子,电极反应式是Cu-2e-===Cu2+。
(2)电极5生成银的质量是2.16g,物质的量是0.02mol,转移0.02mol电子。B池中共收集到224 mL气体(标准状况),则气体的物质的量是0.01mol。如果气体全部是氧气,则转移电子是0.04mol。显然电子的得失不守恒,所以生成的气体中还含有氢气。根据电子的得失守恒可知,阳极生成氧气的物质的量是0.02mol÷4=0.005mol,所以阴极生成的氢气是0.01mol-0.005mol=0.005mol。则阴极析出的铜的物质的量是(0.02mol-0.005mol×2)÷2=0.005mol,因此电解硫酸铜溶液的物质的量浓度是0.005mol÷0.2L="0.025" mol/L。
点评:该题的难点在(2)问,需要利用电子守恒,通过讨论得出阴极还有氢气生成,最后再通过电子的守恒计算即可,属于中等难度的试题。
本题难度:一般
4、选择题 下列图示中关于铜电极的连接错误的是
[? ]
A.
B.
C.
D.
参考答案:C
本题解析:
本题难度:一般
5、选择题 如图所示,a、b、c均为石墨电极,d为碳钢电极, 通电进行电解。假设在电解过程中产生的气体全部逸出,下列说法正确的是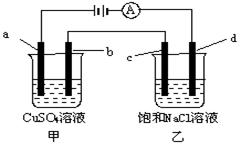
A.甲、乙两烧杯中溶液的pH均保持不变
B.甲烧杯中a的电极反应式为:4OH
参考答案:
本题解析:
本题难度:一般