时间:2019-07-03 23:07:11
1、选择题 铅蓄电池的工作原理为Pb+PbO2+2H2SO4====2PbSO4+2H2O,研读下图,下列判断不正确的是
[? ]
A.K闭合时,d电极反应式:PbSO4+2H2O-2e-====PbO2+4H++SO42-
B.当电路中转移0.2 mol电子时,Ⅰ中消耗的H2SO4为0.2 mol
C.K闭合时,Ⅱ中SO42-向c电极迁移
D.K闭合一段时间后,Ⅱ可单独作为原电池,d电极为正极
参考答案:C
本题解析:
本题难度:一般
2、选择题 双氧水是一种重要的绿色试剂,工业上可采取电解较稀浓度的硫酸来制取双氧水(H2O2都为还原产物),其电解的化学方程式为:3H2O+3O2
? |
参考答案:A.题中“H2O2都为还原产物”,可说明H2O2在电解池阴极生成,O3为阳极产物,故A错误;
B.电解时,阳离子向阴极移动,故B错误;
C.H2O2都为还原产物,则O3为阳极产物,电极反应为3H2O-6e-=O3+6H+,故C正确;
D.产生双氧水的电极反应式为3O2-6e-=3H2O2+6H+,故D错误.
故选C.
本题解析:
本题难度:一般
3、填空题 (15分)研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下放热反应:
2NO2(g)+NaCl(s) NaNO3(s)+ClNO(g) K1 ?H ="a" kJ/mol (I)
NaNO3(s)+ClNO(g) K1 ?H ="a" kJ/mol (I)
2NO(g)+Cl2(g) 2ClNO(g) K2 ?H ="b" kJ/mol (II)
2ClNO(g) K2 ?H ="b" kJ/mol (II)
(1)反应4NO2(g)+2NaCl(s) 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K= (用K1、K2表示),?H= kJ/mol(用a、b表示)。
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K= (用K1、K2表示),?H= kJ/mol(用a、b表示)。
(2)为研究不同条件对反应(II)的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,10min时反应(II)达到平衡。测得10min内v(ClNO)=7.5×10-3mol?L-1?min-1,则平衡后
n(Cl2)= mol。其它条件保持不变,反应(II)在恒压条件下进行,平衡常数K2 (填“增大”“减小”或“不变”)。
(3)实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH=NaNO3+NaNO2+H2O。含0.2mol NaOH的水溶液与0.2mol NO2恰好完全反应得1L溶液A,溶液B为0.1mol?L?1的CH3COONa溶液,则两溶液中c(NO3?)、c(NO2-)和c(CH3COO?)由大到小的顺序为 。(已知HNO2的电离常数Ka=7.1×10-4mol?L?1,CH3COOH的电离常数K a=1.7×10-5mol?L?1)
(4)由有机阳离子、Al2Cl7—和AlCl4—组成的离子液体作电解液时,可在钢制品上电镀铝。
钢制品应接电源的 极,已知电镀过程中不产生其他离子且有机阳离子不参与电极反应,阴极电极反应式为 。若改用AlCl3水溶液作电解液,则阴极产物为 。
参考答案:(1)K12/ K2 2a-b (2)0.025 不变;
(3)c(NO3?) > c(NO2-) > c(CH3COO?);(4) 负(1分);4 Al2Cl7-+3e?=Al+7 AlCl4-;H2(各2分)
本题解析:(1)根据方程式可得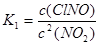 ;
;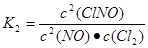 ;
;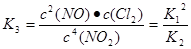 ;则?H="(2a-b)" kJ/mol;(2)v(ClNO)=7.5×10-3mol?L-1?min-1,则v(Cl2)="1/2" v(ClNO)=3.75×10-3mol?L-1?min-1,反应过程消耗的Cl2的物质的量是3.75×10-3mol?L-1?min-1×10min×2L=0.075mol,则平衡后n(Cl2)=0.1mol—0.075mol=0.025mol;其它条件保持不变,反应(II)在恒压条件下进行,由于温度不变,所以平衡常数不变;(3)实验室用NaOH溶液吸收NO2,反应为2NO2+2NaOH=NaNO3+NaNO2+H2O。含0.2mol NaOH的水溶液与0.2mol NO2恰好完全反应得1L溶液A,根据方程式可知该溶液中含有0.1mol的NaNO3和0.1mol的NaNO2;溶液B为0.1mol?L?1的CH3COONa溶液,硝酸是强酸完全电离,NO3-在溶液中不水解,形成盐的酸电离平衡常数越小,则其相同浓度的盐水解程度就越大,溶液中含有该盐的离子的浓度就越小。由于电离平衡常数K(HNO2)>K(CH3COOH),则两溶液中c(NO3?)>c(NO2-)>c(CH3COO?); (4)在钢制品上电镀铝时,钢制品应作阴极,接电源的负极,则阴极电极反应式为4 Al2Cl7-+3e?=Al+7AlCl4-。若改用AlCl3水溶液作电解液,则阴极是溶液中的H+得到电子变为氢气,所以阴极产物为H2。
;则?H="(2a-b)" kJ/mol;(2)v(ClNO)=7.5×10-3mol?L-1?min-1,则v(Cl2)="1/2" v(ClNO)=3.75×10-3mol?L-1?min-1,反应过程消耗的Cl2的物质的量是3.75×10-3mol?L-1?min-1×10min×2L=0.075mol,则平衡后n(Cl2)=0.1mol—0.075mol=0.025mol;其它条件保持不变,反应(II)在恒压条件下进行,由于温度不变,所以平衡常数不变;(3)实验室用NaOH溶液吸收NO2,反应为2NO2+2NaOH=NaNO3+NaNO2+H2O。含0.2mol NaOH的水溶液与0.2mol NO2恰好完全反应得1L溶液A,根据方程式可知该溶液中含有0.1mol的NaNO3和0.1mol的NaNO2;溶液B为0.1mol?L?1的CH3COONa溶液,硝酸是强酸完全电离,NO3-在溶液中不水解,形成盐的酸电离平衡常数越小,则其相同浓度的盐水解程度就越大,溶液中含有该盐的离子的浓度就越小。由于电离平衡常数K(HNO2)>K(CH3COOH),则两溶液中c(NO3?)>c(NO2-)>c(CH3COO?); (4)在钢制品上电镀铝时,钢制品应作阴极,接电源的负极,则阴极电极反应式为4 Al2Cl7-+3e?=Al+7AlCl4-。若改用AlCl3水溶液作电解液,则阴极是溶液中的H+得到电子变为氢气,所以阴极产物为H2。
考点:考查化学平衡常数的关系、盖斯定律的应用、反应热的计算、化学反应速率的计算、电解原理的应用的知识。
本题难度:困难
4、选择题 能正确表示下列反应的离子方程式是( )
A.NaNO2溶液中加入酸性KMnO4溶液:2MnO4-+5NO2-+ 6H+ =2Mn2+ + 5NO3- + 3H2O
B.碳酸氢铵溶液中加入足量氢氧化钡溶液: NH4++HCO3-+2OH-=CO32-+ NH3?H2O +H2O
C.Fe(NO3)3溶液中加入过量的HI溶液:2Fe3+ + 2I- =2Fe 2+ + I2
D.用惰性电极电解熔融氯化钠: 2Cl—+2H2O=Cl2↑+H2↑+2OH-
参考答案:A
本题解析:A.符合反应事实,拆写无误,正确;B.碳酸氢铵溶液中加入足量氢氧化钡溶液要以碳酸氢铵为标准来书写,离子方程式是: NH4++HCO3-+Ba2++2OH-=BaCO3↓+ NH3?H2O +H2O,正确;C.Fe(NO3)3溶液中加入过量的HI溶液:2NO3-+8H+ + 6I- ="2NO↑+" 3I2 +4H2O,错误;D.用惰性电极电解熔融氯化钠: 2Cl—+2Na+ Cl2↑+2Na
Cl2↑+2Na
考点:考查离子方程式的正误判断的知识。
本题难度:一般
5、选择题 某溶液中含有两种溶质NaCl和H2SO4,它们的物质的量之比为3:1.用石墨作电极电解该混合溶液时,根据电极产物,可明显分为三个阶段.下列叙述正确的是( )
A.阴极自始自终只析出H2
B.溶液pH不断增大,最后为7
C.电解最后阶段为电解水
D.阳极先析出Cl2,后极出O2
参考答案:可以将溶质看成3molNaCl和1molH2SO4,再转化一下思想,可以看成2molHCl,1molNa2SO4,1molNaCl,
由于1molNa2SO4自始至终无法电离,且其溶液pH=7,暂时可以忽略,
则电解过程可先看成电解HCl,再电解NaCl,最后电解水,
即2HCl?通电?.?H2↑+Cl2↑,2NaCl+2H2O?通电?.?2NaOH+H2↑+Cl2↑,2H2O?通电?.?2H2↑+O2↑,
生成的NaOH为碱性,pH大于7.
A、阴极自始自终是氢离子放电,只析出H2,故A正确;
B、溶液pH不断增大,最后生成的NaOH为碱性,pH大于7,故B错误;
C、电解最后阶段为电解水,故C正确;
D、阳极氯离子先于氢氧根离子放电,先析出Cl2,后析出O2,故D正确.
故选ACD.
本题解析:
本题难度:一般