时间:2019-07-03 22:57:54
1、填空题 将锌片和银片浸入稀硫酸中组成原电池,两电极间连接一个电流计.
锌片上发生的电极反应:______;
银片上发生的电极反应:______.
参考答案:根据电极材料的活泼性知,锌作负极,银作正极,负极上锌失电子变成离子进入溶液;正极上,溶液中的氢离子得电子生成氢气,
故答案为:(-)Zn-2e-=Zn2+?
?(+)?2H++2e-=H2↑
本题解析:
本题难度:一般
2、选择题 一学生欲通过实验判断X,Y,Z,W四块金属的活泼性,做了如下实验并得结论:当X,Y组成原电池时,Y为负极;当Z,W组成原电池时,W为正极;W能将Y从其盐溶液中置换出来,据此可知它们的活泼性顺序是( )
A.Z>W>X>Y
B.X>Y>Z>W
C.X>Y>W>Z
D.Z>W>Y>X
参考答案:当X,Y组成原电池时,Y为负极,说明活泼性Y>X,当Z,W组成原电池时,W为正极,说明Z做原电池的负极,所以活泼性Z>W,W能将Y从其盐溶液中置换出来,说明活泼性W>Y,综上可知金属的活泼性顺序是Z>W>Y>X.
故选D.
本题解析:
本题难度:一般
3、选择题 下列图示的装置不属于原电池的是
[? ]
A.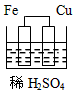
B.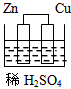
C.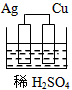
D.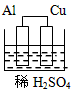
参考答案:C
本题解析:
本题难度:简单
4、填空题 (7分)如下图所示,烧杯中都盛有稀硫酸。?
(1)中反应的离子方程式为?。(2分)?
(2)中的电极反应:Fe:?,?Sn:?。?
(3)中被腐蚀的金属是?,其电极反应式为?。?
比较(1)、(2)、(3)中纯铁被腐蚀的速率由快到慢的顺序是?。
参考答案:(共7分)(1)Fe+2H+==Fe2++H2↑(2分)
(2)Fe-2e-==Fe2+(1分),? 2H++2e-==H2↑(1分)
(3)Zn(1分), Zn-2e-==Zn2+(1分),(2)>(1)>(3)(1分)
本题解析:(1)装置(1)铁中间和稀硫酸反应置换反应,方程式为Fe+2H+==Fe2++H2↑。
(2)装置(2)中铁比锡活泼,所以铁是负极,锡是正极,电极反应式分别是Fe-2e-==Fe2+、2H++2e-==H2↑。
(3)装置(3)中锌比铁活泼,所以锌是负极,铁是正极,因此倍腐蚀的是锌,方程式为Zn-2e-==Zn2+。根据以上分析可知,(1)、(2)、(3)中纯铁被腐蚀的速率由快到慢的顺序是(2)>(1)>(3)。
本题难度:一般
5、选择题 下列有关能量变化过程的说法正确的是
A.无论是风力发电还是潮汐发电,都是将化学能转化为电能
B.在稀溶液中所有酸和碱发生的中和反应的反应热数值都相等
C.化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关
D.下图中所存在的反应体系,若使用催化剂,E1会减小;若加热升高体系的温度,E1会增加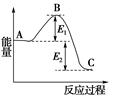
参考答案:C
本题解析:A.风力发电还是潮汐发电,都是将机械能转化为电能;
B.在稀溶液中所有强酸和强碱发生的中和反应的反应热数值都相等,为57.3kj/mol;
D.使用催化剂,可以降低活化能,E1会减小;但加热升高体系的温度,活化能E1仍然保持不变。
点评:考查化学基本常识,及活化能相关知识。
本题难度:简单