时间:2019-07-03 22:57:54
1、选择题 以锌片和铜片为两极,以稀硫酸为电解质溶液组成原电池,当导线中通过2mol电子时,下列说法正确的是(?)
A.锌片溶解了1mol时,铜片上析出1mol氢气
B.两极上溶解和析出的物质质量相等
C.锌片溶解了1g,铜片上析出1g氢气
D.锌片溶解了1mol,硫酸消耗了1mol
参考答案:AD
本题解析:在涉及原电池的有关计算中,关键是要把握住一点,即两极得、失电子数应相等。利用这一特点,我们从电极反应看:负极:Zn-2e-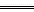 Zn2+,正极:2H++2e-
Zn2+,正极:2H++2e-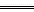 H2↑。溶解1 mol锌失去2 mol电子;铜片上析出1 mol氢气也得到2 mol电子,得失电子守恒,这样即可推出A、D为选项。
H2↑。溶解1 mol锌失去2 mol电子;铜片上析出1 mol氢气也得到2 mol电子,得失电子守恒,这样即可推出A、D为选项。
本题难度:一般
2、选择题 下列有关说法正确的是
A.锌锰干电池中,锌电极是正极
B.电解MgCl2饱和溶液,可制得金属镁
C.锡青铜(铜锡合金)文物在潮湿环境中的腐蚀比干燥环境中快
B.铜锌原电池工作时,电子沿外电路从铜电极流向锌电极
参考答案:C
本题解析:略
本题难度:简单
3、选择题 全钒液流储能电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,原理如图所示。若负载是镀铜的电镀槽,则左槽溶液由黄色逐渐变为蓝色,下列有关说法正确的是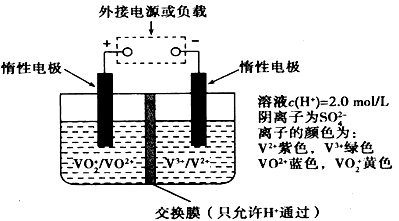
A.外接负载时,左槽作为原电池负极,发生氧化反应
B.外接电源时,左槽连接外接电源的正极,发生还原反应
C.负载是镀铜的电镀槽时,H+由左槽向右槽移动
D.充电时若转移的电子数为3.01×1023个,左槽溶液中n(H+)的变化量为0.5mol
参考答案:D
本题解析:根据题意知,外加负载时该装置为原电池,左槽溶液由黄色逐渐变为蓝色,VO2+转化为VO2+,钒元素的化合价降低发生还原反应,为原电池的正极。A、外接负载时,左槽作为原电池正极,发生还原反应,错误;B、该装置放电时左槽为正极,发生还原反应,充电时左槽发生氧化反应,连接外接电源的正极,错误;C、负载是镀铜的电镀槽时,H+移向电源的正极,应由右槽向左槽移动,错误;D、充电时左槽的电极反应式为VO2++H2O—e- VO2++2H+,若转移的电子数为3.01×1023个,左槽溶液中生成1mol氢离子,其中有0.5mol通过交换膜进入右槽,左槽n(H+)的变化量为0.5mol,正确。
VO2++2H+,若转移的电子数为3.01×1023个,左槽溶液中生成1mol氢离子,其中有0.5mol通过交换膜进入右槽,左槽n(H+)的变化量为0.5mol,正确。
考点:考查电化学,原电池原理的应用、化学电源。
本题难度:困难
4、选择题 下列各组材料中不能组成原电池的是( )
A.锌片、石墨、硫酸溶液
B.铜片、银片、氯化铁溶液
C.锌片、铜片、乙醇溶液
D.铁片、铜片、稀盐酸
参考答案:A、锌是活泼金属,石墨能导电,锌和硫酸能自发的发生氧化还原反应,所以能形成原电池,故A错误;
B、两金属的活泼性不同,且铜片能自发的与氯化铁发生氧化还原反应,所以能形成原电池,故B错误;
C、两金属的活泼性不同,但是乙醇是非电解质,所以不能形成原电池,故C正确;
D、铁是活泼金属,银能导电,铁和硫酸能自发的发生氧化还原反应,所以能形成原电池,故D错误.
故选C.
本题解析:
本题难度:简单
5、选择题 下列各组的电极材料和电解液,不能组成原电池的是
[? ]
A.铜片、石墨棒,稀硫酸
B.铜片、石墨棒,硝酸银溶液
C.锌片、铜片,稀盐酸
D.铜片、银片,FeCl3溶液
参考答案:A
本题解析:
本题难度:简单