时间:2019-06-28 22:12:25
1、实验题 如图是某同学设计的放热反应的观察装置。?

2、实验题 (12分)实验室常用准确称量的邻苯二甲酸氢钾(结构简式如图所示)来准确测定NaOH标准溶液的浓度,即分析化学实验中常称为“标定”的一种方法。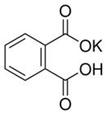
已知:①NaOH溶液的浓度在0.1 mol·L-1左右,滴定终点时溶液的pH应为9.1。
②邻苯二甲酸氢钾相对分子质量为204
(1)写出邻苯二甲酸氢钾与NaOH反应的离子方程式________________________。
(2)将用托盘天平称好的邻苯二甲酸氢钾放于锥形瓶中,加适量的水溶解,溶液呈无色,
再加入指示剂______(从甲基橙、酚酞中选择),用NaOH溶液滴定到终点时,现象是____________。
某学生进行了四次实验,实验数据如下表:
| 实验编号 | 邻苯二甲酸氢钾的质量(g) | 待测NaOH溶液的体积(mL) |
| 1 | 0.4080 | 18.20 |
| 2 | 17.10 | |
| 3 | 16.90 | |
| 4 | 17.00 |
3、实验题 某化学课外活动小组在实验室设计了如下图所示的实验装置,进行“氨的催化氧化”实验。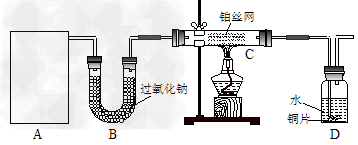
(1)A处是气体发生装置,A中所用的试剂只能从下列物质中选取: ①硝酸铵;②碳酸铵;③碳酸氢铵;④氯化铵;⑤熟石灰;⑥氢氧化钠。若A中制取气体时只用了一种药品,则该药品可以是_______________(填选项编号),在只用一种药品制取氨气时,图中空白处所需仪器应为____________________(选填下列仪器编号,固定装置省略)。 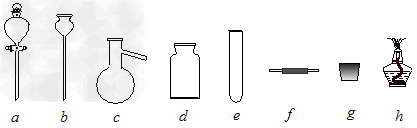
(2)该装置补充完整后,仍然存在一定缺陷,试从安全与环保的角度来考虑,对该装置进行改进:
①_______________________________________;
②_______________________________________。
(3)按照改进后的装置进行实验,请完成以下问题:
①装置B的作用__________________________________________________________;
②写出C中发生反应的化学方程式:_________________________________________;
③若A、B处试剂足量,则装置D中可以观察到的实 验现象有_____________________。
4、简答题 为了探究HClO的漂白性,某同学设计了如图的实验.
(1)实验室用二氧化锰与浓盐酸共热制得氯气,请写出发生反应的化学方程式______.
(2)通入Cl2后,从集气瓶A中干燥的红色布条不褪色的现象,可得出的结论是______;从集气瓶B中湿润的红色布条褪色的现象可得出的结论是______.
(3)为了确证是HClO使湿润的红色布条褪色,你认为还应增加的实验是______.
5、实验题 MnO2是中学化学中常见的一种试剂,可作氧化剂和催化剂。某兴趣小组通过实验对MnO2的性质进行了一系列的研究。
(1)欲探究MnO2的催化效果,需要用30%的H2O2溶液(密度近似为1 g/cm3)配制浓度为3%的H2O2溶液 (密度近似为1g/cm3)100 mL。简述其配制方法:_________________________。
(2)该小组设计了如下4个方案以验证MnO2的氧化性,可行的是________。
A.把MnO2固体加入到FeSO4溶液中,再加入KSCN溶液,观察溶液是否变红
B.把MnO2固体加入到FeCl3溶液中,再加入KSCN溶液,观察溶液是否变红
C.把MnO2固体加入到Na2SO3溶液中,再加入BaCl2溶液,观察是否有白色沉淀生成
D.把MnO2固体加入到稀盐酸中,观察是否有黄绿色气体生成
(3)该小组为研究在不同酸碱性的溶液中MnO2的氧化能力,他们控制KI溶液的浓度和MnO2固体的质量相同,恒定实验温度在298K,设计如下对比实验。 
从上述对比实验中,可以得出的结论是__________________。写出在酸性条件下,MnO2氧化I-的离子方程式_____________________。
(4)利用二氧化锰的氧化性,让其与浓盐酸反应制取氯气,下列仪器可作为该反应的反应容器的是
_________ (填序号)。 