时间:2019-06-28 22:11:05
1、选择题 把300ml有BaCl2和AlCl3的混合溶液分成3等份,取一份加入含a mol硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入等体积4bmol/L氢氧化钠溶液,恰好使产生的沉淀溶解。则该混合溶液中氯离子浓度为
A.20a/3 +b
B.20a+3b
C.2a+3b
D.10a+2b
参考答案:B
本题解析:根据反应式Ba2++SO42-=BaSO4↓、Al3++4OH-=AlO2-+2H2O可知,每一份溶液中Ba2+的物质的量是amol,Al3+的物质的量是0.1bmol。所以根据溶液的电中性可知,每一份溶液中氯离子的物质的量是2amol+0.3bmol,则氯离子的浓度是(2amol+0.3bmol)÷0.1L=(20a+3b)mol/L,选项B正确,答案选B。
本题难度:一般
2、选择题 在Na2SO4和Al2(SO4)3的混合溶液中,测得Al3+浓度为0.1mol/L,加入等体积0.3mol/L的BaCl2溶液恰好使SO42-完全沉淀,则混合溶液中Na+的浓度为
A.0.3mol/L
B.0.45mol/L
C.0.6mol/L
D.0.15mol/L
参考答案:A
本题解析:由BaCl2使SO42-完全沉淀,可计算溶液中SO42-的浓度为0.3mol/L,再由电荷守恒,即溶液中SO42-、Al3+、Na+所带正、负电荷代数和为0,列式为: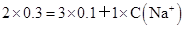 ,计算C(Na+)为0.3mol/L。
,计算C(Na+)为0.3mol/L。
点评:注意此题的解题技巧,电荷守恒的灵活应用。
本题难度:一般
3、选择题 在标况下,0.56g某气体的体积为448 mL,则该气体的相对分子质量为( )
A.2
B.56
C.0.028
D.28
参考答案:D
本题解析:标准状况下,448ml气体的物质的量是0.448L÷22.4L/mol=0.02mol。则根据m=M·n可知,M=0.56g÷0.02mol=28g/mol,所以该气体的相对分子质量为为28,答案选D。
考点:考查物质的量的有关计算
点评:该题是基础性试题的考查,试题注重基础,侧重能力的培养。该类试题学生需要明确的是在进行物质的量的有关计算时,关键是熟练应用几个关系式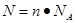 、n=m/M、
、n=m/M、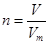 、
、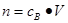 ,特别还要注意气体摩尔体积的使用条件,即只能适用于气体,且只有在标准状况下,气体的摩尔体积才是22.4L/mol。
,特别还要注意气体摩尔体积的使用条件,即只能适用于气体,且只有在标准状况下,气体的摩尔体积才是22.4L/mol。
本题难度:一般
4、选择题 下列配制的溶液浓度偏高的是( )
A.配制稀盐酸用量筒量取浓盐酸时,俯视刻度线
B.用量筒量取所需的浓盐酸倒入烧杯后,再用水洗量筒2-3次,洗液倒入烧杯中
C.称量11.7gNaCl配制0.2mol/LNaCl溶液时,砝码错放在左盘
D.定容时仰视刻度线
参考答案:A、配制稀盐酸用量筒量取浓盐酸时,俯视刻度线,所取盐酸的体积偏少,溶质的质量偏少,浓度偏小,故A错误;
B、用量筒量取所需的浓盐酸倒入烧杯后,再用水洗量筒个-h次,所取盐酸的质量偏大,溶质的质量偏大,浓度偏大,故B正确;
C、因天平称量时左盘的质量=右盘的质量+游码的读数,称量11.7gNaCl配制0.个mol/LNaCl溶液时,砝码错放在左盘,实际称的质量为10.hg,溶质的质量偏小,浓度偏小,故C错误;
D、定容时仰视刻度线,溶液的液面超过刻度线,溶液的体积偏大,溶液的浓度偏小,故D错误;
故选:B.
本题解析:
本题难度:简单
5、选择题 用NA表示阿伏加德罗常数的数值,下列叙述正确的是
A.1 mol NH3与1 mol OH-所含的质子数均为10NA
B.标准状况下,22.4L CHCl3中含C—H键数目为NA
C.常温下,14 g乙烯中含碳原子数为NA
D.常温下,pH=13的NaOH溶液中含OH-数目为NA
参考答案:C
本题解析:A、分子与离子的质子数即所含有的所有原子的质子数之和,1 mol NH3所含的原子的质子数之和=(7+3)mol=10mol,1molOH-所含的原子的质子数之和=(8+1)mol=9mol,故A错误;B、标准状况下,CHCl3是液体,不能用气体体积方式计算,故B错误;C、14 g乙烯物质的量为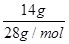 =0.5mol,每个C2H4分子中含有2个碳原子,即0.5mol乙烯分子中含有1mol碳原子,原子数为NA,故C正确;D、pH=13的NaOH溶液表示溶液中OH-离子的浓度为0.1mol/L,没有体积无法计算具体数目,故D错误。
=0.5mol,每个C2H4分子中含有2个碳原子,即0.5mol乙烯分子中含有1mol碳原子,原子数为NA,故C正确;D、pH=13的NaOH溶液表示溶液中OH-离子的浓度为0.1mol/L,没有体积无法计算具体数目,故D错误。
本题难度:一般