时间:2019-06-28 22:11:05
1、选择题 实验室使用的浓盐酸的溶质质量分数为36.5%,密度为1.19g?cm3,则物质的量浓度是( )
A.11.9
B.11.9mol?L-1
C.0.012mol?L-1
D.无法计算
参考答案:盐酸的溶质质量分数为36.5%,密度为1.19g?cm3,
则该浓盐酸的物质的量浓度为1000×1.19×36.5%36.5mol/L=11.9mol/L.
故选:B.
本题解析:
本题难度:一般
2、填空题 (6分)100mL 1 mol·L-1Al2(SO4)3溶液中含SO42-离子?个,含Al3+离子?mol。0.6mol O2与0.4mol O3质量之比为?,分子个数之比为?,原子个数之比?, 它们在同温同压下的体积比是?
参考答案:(6分)1.806×1023 ,? 0.2,? 1:1,? 3:2,? 1:1,? 3:2
本题解析:略
本题难度:一般
3、填空题 当三份铜粉分别与过量的稀硝酸、浓硝酸、热的浓硫酸充分反应后,收集到的气体在相同状况下体积相等时(不考虑NO2转化为N2O4 、生成气体溶解及产生水蒸气的体积),其三份铜的质量比为?
(2)1.28克铜与适量的浓硝酸反应,铜完全溶解,共收集到672 ml NO、NO2混合气(标准状况),则反应中共消耗HNO3的物质的量为?
(3)用20ml 18.4 mol/L浓硫酸和铜共热一段时间后,冷却、过滤,将滤液稀释到100ml,测得溶液中SO42— 的浓度为3.18mol/L,则该溶液CuSO4的物质的量浓度为?
(4)Na2SiO3可以改写成氧化物的形式为Na2O·SiO2,则质量分数为98%的浓硫酸改写成氧化物的形式为?。
参考答案:(11分)(1) 3:1:2?(2)0.07 mol?(3) 0.5 mol/L?(4) SO3·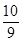 H2O
H2O
本题解析:(1)铜与稀硝酸、浓硝酸和浓硫酸反应的化学方程式分别是3Cu + 8HNO3(稀)=3Cu(NO3)2 + 2NO↑+ 4H2O、Cu + 4HNO3(浓)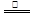 Cu(NO3)2 + 2NO2↑+ 2H2O、Cu+2H2SO4(浓)
Cu(NO3)2 + 2NO2↑+ 2H2O、Cu+2H2SO4(浓)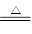 CuSO4+2H2O+SO2↑。当反应中生成当气体体积相等时(假设均是2mol),则根据方程式可知,消耗铜的质量之比是3:1:2。
CuSO4+2H2O+SO2↑。当反应中生成当气体体积相等时(假设均是2mol),则根据方程式可知,消耗铜的质量之比是3:1:2。
(2)1.28g铜的物质的量是1.28g÷64g/mol=0.02mol,则生成硝酸铜就是0.02mol。672 ml NO、NO2混合气(标准状况)的物质的量是0.672L÷22.4L/mol=0.03mol,实验根据氮原子守恒可知,参加反应的硝酸的物质的量是0.02mol×2+0.03mol=0.07mol。
(3)反应前浓硫酸的物质的量是0.02L×18.4mol/L=0.368mol,反应后溶液中SO42-的物质的量是0.10L×3.18mol/L=0.3186mol,则根据S原子守恒可知,反应中生成SO2的物质的量是0.368mol-0.318mol=0.05mol,所以根据电子得失守恒可知,参加反应的铜的物质的量是0.05mol,则硫酸铜的物质的量是0.05mol,其浓度是0.05mol÷0.1L=0.5mol/。
(4)98%的浓硫酸中硫酸和水的物质的量之比是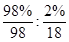 =9:1,由于硫酸可以看作是SO3·H2O,所以98%的浓硫酸改写成氧化物的形式为SO3·
=9:1,由于硫酸可以看作是SO3·H2O,所以98%的浓硫酸改写成氧化物的形式为SO3·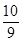 H2O。
H2O。
点评:该题是中等难度的试题,试题基础性强,难易适中,注重解题的灵活性,有利于培养学生的逻辑推理能力和发散思维能力。明确反应的原理并能依据守恒法答题是关键。守恒法是计算题中最常用也是最重要的解题方法,常见守恒法有质量守恒、原子守恒、电荷守恒、电子的得失守恒等,需要平时学习中注意积累和总结。
本题难度:一般
4、选择题 已知3.01×1023个X气体分子的质量为8 g,则X气体的摩尔质量是(?)
A.16 g
B.32 g
C.16g /mol
D.32 g /mol
参考答案:D
本题解析:略
本题难度:一般
5、计算题 向50mL稀硫酸和稀盐酸的混合溶液中,加入3.42g氢氧化钡粉末,充分反应后过滤,得到干燥的沉淀物2.33g,所得溶液中氢氧根离子的浓度为0.1mol/L,试求原混合液中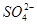 和
和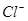 的物质的量浓度(假定在混合液中加入氢氧化钡粉末后体积未改变)。
的物质的量浓度(假定在混合液中加入氢氧化钡粉末后体积未改变)。
参考答案:解:设混酸中含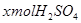 ,y mol HCl;与
,y mol HCl;与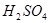 反应的
反应的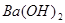 为z mol。
为z mol。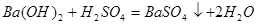
1mol? 1mol? 1mol
z? x?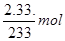 ?解得:x=0.01mol, z=0.01mol
?解得:x=0.01mol, z=0.01mol
则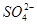 的物质的量浓度
的物质的量浓度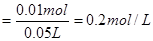 ?
?
与HCl反应的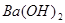 物质的量为:
物质的量为: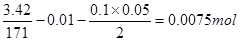
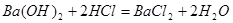
1mol?2mol
0.0075mol?y
解得:y=0.015mol则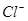 的物质的量浓度
的物质的量浓度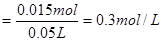 ?答:……
?答:……
本题解析:得到干燥的沉淀物为BaSO4,根据BaSO4的量可以求出H2SO4的物质的量,进而求出SO42?的浓度,然后用Ba(OH)2的总量减去剩余的Ba(OH)2和与H2SO4的Ba(OH)2,可得与HCl反应的Ba(OH)2的量,从而求出Cl?的浓度。
本题难度:一般