时间:2019-06-28 22:04:29
1、填空题 为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应的措施。化学反应的焓变通常用实验进行测定,也可进行理论推算。
(1)实验测得,5 g甲醇(CH3OH,液态)在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5 kJ的热量,试写出甲醇燃烧的热化学方程式: 。
(2)已知化学键的键能为:
| 化学键 | H—H | N—H |  |
| 键能/( kJ·mol-1) | 436 | 391 | 945 |
 2NH3(g) ΔH="a" kJ·mol-1。试根据表中所列键能数据估算a的值为 。
2NH3(g) ΔH="a" kJ·mol-1。试根据表中所列键能数据估算a的值为 。  CO2(g) ΔH="-393" kJ·mol-1
CO2(g) ΔH="-393" kJ·mol-1 2H2O(l) ΔH=-571.6 kJ·mol-1
2H2O(l) ΔH=-571.6 kJ·mol-1 4CO2(g)+2H2O(l) ΔH="-2" 599 kJ·mol-1
4CO2(g)+2H2O(l) ΔH="-2" 599 kJ·mol-1参考答案: (1)2CH3OH(l)+3O2(g) 2CO2(g)+4H2O(l) ΔH="-1" 452.8 kJ· mol-1
2CO2(g)+4H2O(l) ΔH="-1" 452.8 kJ· mol-1
(2)-93;(3)+227.7 kJ· mol-1
本题解析: (1)5 g甲醇完全燃烧放出113.5 kJ的热量,则1 mol甲醇完全燃烧放出726.4 kJ的热量。
(2)ΔH="945" kJ·mol-1+436 kJ·mol-1×3-391 kJ·mol-1×6="-93" kJ·mol-1,所以a=-93。
(3)①×2+②÷2-③÷2,得2C(石墨,s)+H2(g) C2H2(g) ΔH=+227.7 kJ·mol-1。
C2H2(g) ΔH=+227.7 kJ·mol-1。
考点:化学反应热的计算
本题难度:一般
2、选择题 (6分)(2012?重庆)肼(H2N
参考答案:
本题解析:
本题难度:一般
3、选择题 下列反应的离子方程式书写正确的是
A.向饱和碳酸氢钙溶液中加入过量的氢氧化钠溶液 Ca2++HCO3-+OH-=CaCO3↓+H2O
B.向偏铝酸钠溶液中通入过量二氧化碳气体 AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
C.碳酸钡溶于醋酸溶液 BaCO3+2H+=Ba2++CO2↑+H2O
D.在三氯化铁的酸性溶液中通入足量的硫化氢 2Fe3++S2-=2Fe2++S↓
参考答案:B
本题解析:分析:A、向饱和碳酸氢钙溶液中加入过量的氢氧化钠溶液是,碳酸氢钙会完全反应;
B、向偏铝酸钠溶液中通入过量二氧化碳气体会生成氢氧化铝和碳酸氢钠;
C、醋酸是弱酸,在离子方程式中不能拆成离子的形式;
D、氢硫酸是弱酸,在离子方程式中不能拆成离子的形式.
解答:A、向饱和碳酸氢钙溶液中加入过量的氢氧化钠溶液是,碳酸氢钙会完全反应,求钙离子和碳酸氢根按照物质的量之比是1:2进行反应,极Ca2++2HCO3-+2OH-=CaCO3↓+H2O+CO32-,故A错误;
B、向偏铝酸钠溶液中通入过量二氧化碳气体会生成氢氧化铝和碳酸氢钠,实质是:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,故B正确;
C、醋酸酸性强于碳酸,碳酸钡溶于醋酸溶液发生反应的实质为:BaCO3+2CH3COOH=Ba2++CO2↑+H2O+2CH3COO-,故C错误;
D、硫化氢显酸性,并且硫有还原性,三价铁具有氧化性,在三氯化铁的酸性溶液中通入足量的硫化氢会发生氧化还原反应:2Fe3++H2S═2Fe2++S↓+2H+,故D错误.
故选B.
点评:本题是一道关于离子方程式书写正误的判断题,是现在考试的热点,难度不大.
本题难度:困难
4、填空题 (6分)按要求写热化学方程式:
(1)已知稀溶液中,1 mol H2SO4与NaOH溶液恰好完全反应生成正盐时,放出114.6 kJ热量,写出表示H2SO4与NaOH反应的热化学方程式_____________________。
(2)25℃、101 kPa条件下充分燃烧一定量的丁烷气体放出热量为Q kJ,经测定,将生成的CO2通入足量澄清石灰水中产生25 g白色沉淀,写出表示丁烷燃烧热的热化学方程式?。
(3)已知下列热化学方程式:
①CH3COOH(l)+2O2(g)===2CO2(g)+2H2O(l)? ΔH1=-870.3 kJ/mol
②C(s)+O2(g)===CO2(g)? ? ΔH2=-393.5 kJ/mol
③H2(g)+O2(g)===H2O(l )?ΔH3=-285.8 kJ/mol
写出由C(s)、H2(g)和O2(g)化合生成CH3COOH(l)的热化学方程式?。
参考答案:(1)H2SO4(aq)+NaOH(aq)===Na2SO4(aq)+H2O(l) ? ΔH=-57.3 kJ/mol(化学计量数、ΔH可成比例变化)
(2)C4H10(g)+O2(g)===4CO2(g)+5H2O(l)?ΔH=-16Q kJ/mol
(3)2C(s)+2H2(g)+O2(g)===CH3COOH(l)?ΔH=-488.3 kJ/mol
本题解析:考查热化学方程式的书写。
(1)中和反应是放热反应,△H小于0,反应式为H2SO4(aq)+NaOH(aq)===Na2SO4(aq)+H2O(l) ? ΔH=-57.3 kJ/mol。
(2)25 g白色沉淀是碳酸钙,其物质的量是 ,根据碳原子守恒可知,生成的CO2是0.25mol,则生成1molCO2放出的热量是4QkJ。燃烧热是指1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,所以丁烷燃烧热的热化学方程式为C4H10(g)+O2(g)===4CO2(g)+5H2O(l)?ΔH=-16Q kJ/mol。
,根据碳原子守恒可知,生成的CO2是0.25mol,则生成1molCO2放出的热量是4QkJ。燃烧热是指1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,所以丁烷燃烧热的热化学方程式为C4H10(g)+O2(g)===4CO2(g)+5H2O(l)?ΔH=-16Q kJ/mol。
(3)考查盖斯定律的应用和反应热的计算。将②×2+③×2-①,即得到2C(s)+2H2(g)+O2(g)===CH3COOH(l),所以反应热是-393.5kJ/mol×2-285.8 kJ/mol×2+870.3 kJ/mol=-488.3 kJ/mol。
本题难度:一般
5、填空题 氨在工农业生产中应用广泛。在压强为30MPa时,合成氨平衡混合气体中NH3的体积分数如下:
| 温度/°C | 200 | 300 | 400 | 500 | 600 |
| 氨含量/% | 89.9 | 71.0 | 47.0 | 26.4 | 13.8 |
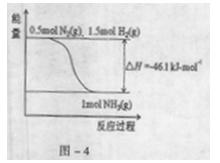
 2NH3,2min达到平衡状态时,H2转化率是50%,则用H2表示该反应的平均速率v(H2)= ;该温度下的平衡常数K= (用分数表示);俗使K增大,可以采取的措施是 。
2NH3,2min达到平衡状态时,H2转化率是50%,则用H2表示该反应的平均速率v(H2)= ;该温度下的平衡常数K= (用分数表示);俗使K增大,可以采取的措施是 。参考答案:
本题解析:略
本题难度:一般