时间:2019-06-28 22:04:29
1、填空题 运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。 (1)合成氨反应反应N2(g)+3H2(g)
(1)合成氨反应反应N2(g)+3H2(g) 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡?移动(填“向左”“向右”或“不”);,使用催化剂?反应的ΔH(填“增大”“减小”或“不改变”)。
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡?移动(填“向左”“向右”或“不”);,使用催化剂?反应的ΔH(填“增大”“减小”或“不改变”)。 (2)O2 (g)= O+2(g)+e-?
(2)O2 (g)= O+2(g)+e-?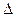 H1=" 1175.7" kJ·mol-1
H1=" 1175.7" kJ·mol-1 PtF6(g)+ e-1
PtF6(g)+ e-1 PtF6-(g)?
PtF6-(g)?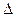 H2=" -" 771.1 kJ·mol-1
H2=" -" 771.1 kJ·mol-1 O2+PtF6-(s)=O2+(g)+PtF6- ?
O2+PtF6-(s)=O2+(g)+PtF6- ? H3="482.2" kJ·mol-1
H3="482.2" kJ·mol-1 则反应O2(g)+ PtF6 (g) = O2+PtF6- (s)的
则反应O2(g)+ PtF6 (g) = O2+PtF6- (s)的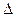 H="_____________" kJ·mol-1。
H="_____________" kJ·mol-1。 (3)在25℃下,向浓度均为0.1 mol·L-1的MgCL2和CuCl2混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式为____________。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.2×10-20。
(3)在25℃下,向浓度均为0.1 mol·L-1的MgCL2和CuCl2混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式为____________。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.2×10-20。 (4)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4*)=c(Cl-),则溶液显_____________性(填“酸”“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb=__________。
(4)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4*)=c(Cl-),则溶液显_____________性(填“酸”“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb=__________。
2、选择题 下列说法正确的是
A.化学反应中的能量变化都表现为热量的变化
B.需要加热才能发生的反应一定是吸热反应
C.放热反应在常温下一定很容易发生
D.反应是吸热还是放热必须看反应物和生成物的总能量的大小
3、实验题 (12分)(1)用50mL 0.50mol·L-1盐酸与50mL 0.55mol·L-1NaOH溶液在如下图所示的装置中进行中和反应。通过测定反应过程中放出的热量可计算中和热。回答下列问题: 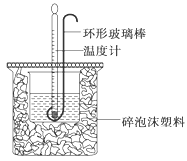
①烧杯间填满碎泡沫塑料的作用是 。
②若大烧杯上改为盖薄铁板,求得的反应热数值: (填“偏大”、“偏小”或“无影响”)
③若通过测定计算产生的热量为1.42kJ,请写该反应的热化学方程式: 。
(2)①已知:CH4(g)+H2O(g)===CO(g)+3H2(g) ΔH=+206.2 kJ·mol-1
CH4(g)+CO2(g)===2CO(g)+2H2(g) ΔH=+247.4 kJ·mol-1
则以甲烷为原料制取氢气是工业上常用的制氢方法。CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为: 。
②由气态基态原子形成1 mol化学键释放的最低能量叫键能。已知表中所列键能数据, 则N2(g)+3H2(g) 2NH3(g) ΔH= kJ·mol-1。
2NH3(g) ΔH= kJ·mol-1。
| 化学键 | H—H | N—H | N≡N |
| 键能kJ·mol-1 | 436 | 391 | 945 |
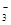 (aq)+2Cl-(aq)的ΔH= kJ·mol-1。
(aq)+2Cl-(aq)的ΔH= kJ·mol-1。
4、选择题 下列各组化合物中化学键类型不同的是( )
A.NaCl和HNO3
B.H2O和NH3
C.MgF2和NaCl
D.H2O和CO2
5、填空题 由反应物粒子一步直接实现的化学反应称为基元反应。某化学反应是通过三步基元反应实现的:
①Ce4++Mn2+→Ce3++ Mn3+;②Ce4++ Mn3+→Ce3++Mn4+;③Ti++ Mn4+→Ti3++ Mn2+。
由此可知,该反应的催化剂是____,起始反应物是___,总反应的化学方程式为____。