时间:2019-06-28 22:04:08
1、选择题 已知破坏1 mol H-H键,Cl-Cl键,H-Cl键分别需要吸收436 kJ,243 kJ,432 kJ的能量,则由H2与Cl2生成
1 mol HCl的总过程需要
[? ]
A.放热185 kJ
B.吸热185 kJ
C.放热92.5 kJ
D.吸热92.5 kJ
参考答案:C
本题解析:
本题难度:一般
2、选择题 已知298 K时,合成氨反应N2(g)+3H2(g)
参考答案:
本题解析:
本题难度:一般
3、选择题 下列化合物中所有化学键都是共价键的是
A.Na2O2
B.NaOH
C.BaCl2
D.CH4
参考答案:D
本题解析:一般活泼的金属和活泼的非金属容易形成离子键,非金属元素的原子间容易形成共价键,据此可知,过氧化钠中含有离子键和非极性键,氢氧化钠中含有离子键和极性键,氯化钡中只有离子键,甲烷中只有共价键,答案选D。
点评:该题是高考中的常见考点,侧重考查学生对化学键判断的了解掌握情况,以及灵活运用基础知识解决实际问题的能力的培养。明确离子键和共价键的判断依据是答题的关键。
本题难度:简单
4、选择题 3 H2(g) + N2(g) 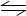 2NH3(g) 反应过程中的能量变化如下图所示。有关说法错误的是( )
2NH3(g) 反应过程中的能量变化如下图所示。有关说法错误的是( )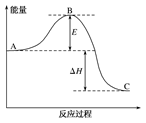
A.图中C表示生成物NH3(g)的总能量
B.断裂3mol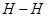 和1mol
和1mol 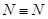 所吸收的总能量大于形成6mol
所吸收的总能量大于形成6mol 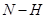 所释放的总能量
所释放的总能量
C.逆反应的活化能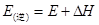
D.3 H2(g) + N2(g) 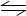 2NH3(g) △H< 0
2NH3(g) △H< 0
参考答案:B
本题解析:A中根据图像可知图中C表示生成物NH3(g)的总能量,正确;B中该反应为放热反应,所以断裂3mol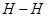 和1mol
和1mol 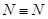 所吸收的总能量小于形成6mol
所吸收的总能量小于形成6mol 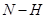 所释放的总能量,错误;C中活化能是指断裂化学键所需吸收的能量,所以逆反应的活化能
所释放的总能量,错误;C中活化能是指断裂化学键所需吸收的能量,所以逆反应的活化能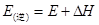 ,正确;D中该反应为放热反应,所以3 H2(g) + N2(g)
,正确;D中该反应为放热反应,所以3 H2(g) + N2(g)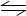 2NH3(g) △H< 0,正确,选B。
2NH3(g) △H< 0,正确,选B。
考点:考查反应热、活化能,化学反应图像等知识。
本题难度:一般
5、填空题 汽车尾气净化中的一个反应如下:2NO(g)+2CO(g) N2(g)+2CO2(g)
N2(g)+2CO2(g)
请回答下列问题:
(1)已知:N2(g)+O2(g)=2NO(g);△H= +180.5kJ/mol
C(s)+O2(g) =CO2(g);△H=" -393.5" kJ/mol
2C(s)+O2(g)=2CO(g);△H= -221kJ/mol
则2NO(g)+2CO(g) N2(g) +2CO2(g)的△H=___________。
N2(g) +2CO2(g)的△H=___________。
(2)在一定温度下,在一体积为V升的密闭容器中充入一定量的NO和CO2在t1时刻达到平衡状态,此时n(CO)="a" mol,n(NO)="2a" mol,n(N2)="b" mol,且N2占平衡总体积的1/4。
①则该反应的平衡常数K=_______?____。(用只含a、V的式子表示)
②判断该反应达到平衡的标志是____?_____
A.v生成(CO2)=v消耗(CO)?B.混合气体的密度不再改变
C.混合气体的平均相对分子质量不再改变? D.NO、CO、N2、CO2的浓度均不再变化
③在t2时刻,将容器的容积迅速扩大到原来的2倍,在其他条件不变的情况下,t3时刻达到新的平衡状态。请在右图中补充画出从t2到t4时刻正反应速率随时间的变化曲线:
(3)如果要净化汽车尾气同时提高该反应的速率和NO的转化率,采取的措施是___________
A.降低温度?B.增大压强同时加催化剂
C.升高温度同时充入N2?D.及时将CO2和N2从反应体系中移走
(4)为避免汽车尾气中的有害气体对大气的污染,给汽车安装尾气净化装置。净化装置里装有含Pd等过渡元素的催化剂,气体在催化剂表面吸附与解吸作用的机理如下图所示。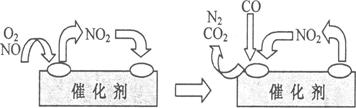
①写出此变化中的总化学反应方程式:_________?_______________________________。
②有人提出,可以设计反应2CO(g)=2C(s)+O2(g)来消除CO的污染。请你判断是否可行并说出理由:_____________________________________________________________。
参考答案:(14分)? (1) △H="-746.5" kJ/mol(2分)? (2)①K=27V/a? (2分)? ②CD(2分)?③(2分)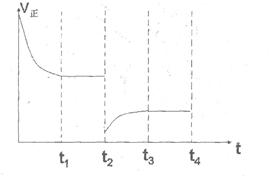
(3)B(2分)? (4)2NO+O2+4CO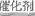 4CO2+N2(2分、)
4CO2+N2(2分、)
②不可行,因为△H>0,△S<0,在任何情况下都不能自发进行。(2分)
本题解析:(1)根据盖斯定律可知,②×2-①-③即得到2NO(g)+2CO(g) N2(g) +2CO2(g),所以该反应的△H=-393.5 kJ/mol×2-180.5kJ/mol+221kJ/mol=-746.5 kJ/mol。
N2(g) +2CO2(g),所以该反应的△H=-393.5 kJ/mol×2-180.5kJ/mol+221kJ/mol=-746.5 kJ/mol。
(2)①达到平衡状态,此时n(CO)="a" mol,n(NO)="2a" mol,n(N2)="b" mol,则CO2的物质的量应该是2bmol。又因为N2占平衡总体积的1/4,则b=3a。由于化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以根据反应式可知,K=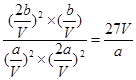 。
。
②在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态,所以D正确。A中反应速率的方向是相同的,速率之比是相应的化学计量数之比,因此A中的关系始终是成立,不正确。密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,B不正确。混合气的平均相对分子质量是混合气的质量和混合气的总的物质的量的比值,质量不变,但物质的量是变化的,所以C可以说明,答案选CD。
③在t2时刻,将容器的容积迅速扩大到原来的2倍,则正逆反应速率均是减小的,但平衡向正反应方向一定,所以正确的图像应该是(见答案)。
(3)该反应是体积减小的、放热的可逆反应,所以要净化汽车尾气同时提高该反应的速率和NO的转化率,采取的措施是选项B,A中反应速率降低,C中转化率降低,D中反应速率降低,答案选B。
(4)①根据图示可知,最终的生成物是CO2和氮气,所以总的方程式是2NO+O2+4CO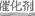 4CO2+N2。
4CO2+N2。
②因为根据反应式可知,该反应的△H>0,△S<0,在任何情况下都不能自发进行,所以是不可取的。
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,贴近高考,侧重对学生能力的培养和解题方法的指导,有助于培养学生逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力。
本题难度:一般