时间:2019-06-28 21:56:54
1、选择题 已知海水略显碱性。分别向等体积的海水和蒸馏水中通入足量的CO2,下列有关说法不正确的是( )。
A.海水和蒸馏水所溶解的CO2一样多
B.海水中溶解的CO2较多
C.海水中的c(HCO3-)较大
D.海水中的c(CO32-)较大
2、选择题 如图所示,电解含有少量酚酞的饱和食盐水。下列有关说法正确的是( )。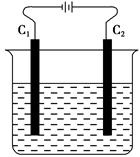
A.C1称为阳极,电解时,该极附近溶液先变红色
B.C2称为正极,电解时,该极上Cl-被还原为氯气
C.电解时若两极产生的物质在溶液中发生作用,整个电解反应为NaCl+H2O=NaClO+H2↑
D.电解时,电流从电源负极经导线至C1经电解质溶液至C2经导线至电源正极
3、选择题 氮的固定是指
A.植物从土壤中吸收含氮养料
B.将空气中的氮气转变为含氮化合物
C.豆科植物根瘤菌将含氮化合物转变为植物蛋白质
D.将氨转变成硝酸及其它氮的化合物
4、选择题 下列有关硫铁矿制硫酸的说法中,正确的是( )。
A.沸腾炉中出来的炉气,可直接进入转化器中进行催化氧化
B.焙烧硫铁矿的反应中,二氧化硫是唯一的氧化产物
C.生产过程中要采用高温高压,以有利于二氧化硫更好地转化为三氧化硫
D.三氧化硫在吸收塔中被吸收时,通常用质量分数为98.3%的硫酸做吸收剂,而不直接用水吸收
5、判断题 瑞士化学家米勒因合成DDT于1948年获得诺贝尔医学奖。在第二次世界大战中的1944年,美国在意大利的许多士兵因使用DDT来扑灭传染斑疹伤寒流行病人身上的虱子而避免丧生。联合国世界卫生组织曾评价说:“单独从疟疾病者,DDT可能拯救了5000万生命。”
但进一步的观察和研究表明,DDT是一种难降解的有毒化合物,进入人体内可引起慢性中毒。我国已于1983年停止生产和使用。
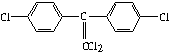
(1)杀虫剂“1605”本身对人畜毒性远强于DDT,但DDT已被禁用,而“1605”尚未禁用,这是为什么?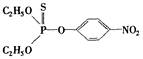 ?
?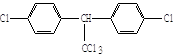
杀虫剂“1605”?杀虫剂DDT
由结构分析知:“1605”在使用过程中,不能与?物质混合使用,否则会因?
(2)DDT可以用电石为原料经以下途径而制得;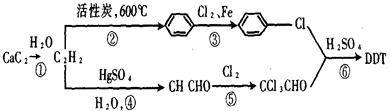
①写出④、⑤、⑥步反应的化学方程式。
②DDT有毒性,国际上已禁止使用,因为它在动物体内转化为一种使动物生长失调的物质(结构如右面所示结构式)。在实验室也可实现这种转化,表示这种转化的化学方程式为?
?