时间:2019-06-28 21:56:54
1、实验题 农业生产中使用最广泛的磷肥是过磷酸钙,其主要成分是?(填化学式);在实际使用中,其不能与草木灰混合施用的原因是(用离子方程式表示)?。目前常用的湿法磷肥生产工艺是用硫酸分解磷矿石(主要成分为Ca5(PO4)3F),这样处理的主要目的是?。
该生产工艺的有关反应为:
2Ca5(PO4)3F+7H2SO4=Ca3(PO4)2+4H3PO4+7CaSO4+2HF
Ca3(PO4)2+4H3PO4=3Ca(H2PO4)2
生成的氟化氢会和磷矿中带入的二氧化硅反应生成SiF4,若直接排放到空气中,将严重污染环境。某磷肥厂改进工艺,在吸收塔中将SiF4经水吸收后转化为氟硅酸(H2SiF6)溶液和硅胶(SiO2),实现氟的循环使用和硅胶的合理利用,以减小对环境的污染,同时创造经济效益。工艺流程如下:
(1)写出吸收塔中反应的化学方程式____?。
(2)该工艺流程中,设计两个吸收塔的目的是?。
(3)氟硅酸与磷酸钙和水反应可生成磷酸二氢钙,原理是:
2H2SiF6+Ca3(PO4)2+4H2O=2CaSiF6·2H20 +Ca(H2PO4)2
CaSiF6·2H2O+2H2O=CaF2·SiO2·2H2O+4HF
4HF+Ca3(PO4)2=2CaF2+Ca(H2PO4)2
若利用氟硅酸与磷酸钙和水反应代替硫酸与磷酸钙反应生产Ca(H2PO4)2,理论上lkg氟硅酸可替代_____kg硫酸。
(4)分离得到的硅胶中因含有H2SiF6而称含氟硅胶,含氟硅胶中SiO2易溶于沸腾的氟化铵溶液,得到(NH4)2SiF6溶液,此反应为可逆反应,加入氨水后,二氧化硅重新析出。写出SiO2与氟化铵反应的化学方程式______?__。
参考答案:(15分)
Ca(H2PO4)2·H2O和CaSO4 (2分); CO32-+H2PO4-+Ca2+=CaHPO4+HCO3-(2分);
使之变为植物可以吸收可溶性的磷酸盐,便于植物吸收(2分)
(1)3SiF4+2H2O=2H2SiF6+SiO2(2分)
(2)提高SiF4R的吸收率(2分)
(3)2.04(2分)
(4)6NH4F(沸腾)+SiO2=(NH4)2SiF6+4NH3+2H2O(3分)
本题解析:K2 CO3和Ca(H2PO4)2反应符合强酸制弱酸原理。Ca5(PO4)3F和 Ca3(PO4)2 不溶,Ca(H2PO4)2可溶。
(3)①2H2SiF6+Ca3(PO4)2+4H2O=2CaSiF6·2H20 +Ca(H2PO4)2
②CaSiF6·2H2O+2H2O=CaF2·SiO2·2H2O+4HF
③4HF+Ca3(PO4)2=2CaF2+Ca(H2PO4)2?
①+②*2+ ③*2?可得关系?2H2SiF6→3Ca(H2PO4)2
④2H2SO4+Ca3(PO4)2="2" CaSO4+ Ca(H2PO4)2?可得关系: 2H2SO4→Ca(H2PO4)2
综合以上两种关系:2H2SiF6→3Ca(H2PO4)2→6H2SO4?设lkg氟硅酸可替代硫酸质量为x。
2*144? 6*98
1? x? x=2.04
本题难度:困难
2、选择题 下图所示装置中,a、b都是惰性电极,通电一段时间后,b极附近溶液呈红色。下列说法中正确的是( )。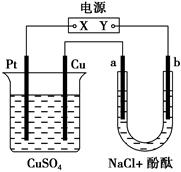
A.X是正极,Y是负极
B.X是负极,Y是正极
C.CuSO4溶液的pH逐渐变小
D.CuSO4溶液的pH不变
参考答案:AC
本题解析:b极变红说明b极区呈碱性,故H+放电得H2,所以b为阴极,a为阳极,X为正极,Y为负极,Pt为阳极,Cu为阴极,电解CuSO4溶液放出O2,故pH变小。
本题难度:简单
3、选择题 电解饱和食盐水两电极上产生气体的体积比应是1∶1,但实际测量时却发现V(H2)>V(Cl2)(常温常压),其原因可能是( )。
A.H2的摩尔质量比Cl2的小
B.Cl2有刺激性气味
C.H2的熔、沸点比Cl2的低
D.H2的溶解度比Cl2的小
参考答案:D
本题解析:由于H2难溶于水而Cl2能溶于水故V(H2)>V(Cl2)。
本题难度:简单
4、选择题 右图是生活中常用的锌锰干电池的示意图,下列有关说法中不正确的是( ? )
