时间:2019-06-28 21:28:41
1、选择题 下列有关物质用途的说法中,正确的是
A.氨气是生产硝酸的重要原料
B.甲烷与氯气反应可制得纯净的一氯甲烷
C.铁制容器可用来盛放稀硝酸
D.油脂经皂化反应可获得高级脂肪酸
2、简答题 三氯化铁是中学化学实验室中常用的化学试剂.某同学利用废铁屑(含少量铜等不与盐酸反应的杂质)来制备FeCl3?6H2O,该同学设计的实验装置如图所示,其实验步骤如下:A中放有废铁屑,烧杯中盛有过量的稀硝酸,实验时打开a,关闭b,从分液漏斗内向A中加过量的盐酸,此时溶液呈浅绿色,再打开b进行过滤,过滤结束后,取烧杯内溶液倒入蒸发皿加热,蒸发掉部分水并使剩余HNO3分解,再降温结晶得FeCl3?6H2O晶体.填写下列空白:
(1)收集导管B处的气体可采用的方法是______.滴加盐酸时,发现反应速率较之盐酸与纯铁粉反应要快,其原因是______.
(2)烧杯内放过量稀HNO3的原因是______.发生反应的离子方程式是______.
(3)整个实验过程中,弹簧夹a都必须打开,除为排出产生的气体外,另一个目的是______.
(4)将烧杯内溶液用蒸发、浓缩、再降温结晶法制得FeCl3?6H2O,而不用直接蒸干的方法来制得晶体的理由是______
(5)你认为该实验存在的缺点可能有:______.
3、实验题 黄铜矿(CuFeS2)是炼钢和炼铜的主要原料.在高温下灼烧生成二氰化二铁和氧化铜。三氧化二铁和氧化亚铜都是红色粉末.常用作颜料。某学校化学兴趣小组通过实验米探究一红色粉末是Fe2O3、Cu2O或两者的混合物。探究过程如下:
【查阅资料】Cu2O是一种碱性氧化物.溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO。
【提出假设】
假设1:红色粉末是Fe2O3。假设2:红色粉末是Cu2O。假设3:红色粉末是Fe2O3和Cu2O的混合物。
【设计探究实验】
取少量粉末放入足量稀硫酸中.在所得溶液中再滴加KSCN试剂。
(1)若假设1成立,则实验现象是?。
(2)滴加KSCN试剂后溶液不变红色.某同学认为原同体粉末中一定不含三氧化二铁。你认为这种说法合理吗??。简述你的理由(不需写出反应的化学方程式):?。
(3)若固体粉末未完全溶解,仍然有固体存在.滴加KSCN试剂时溶液不变红色.则证明原固体粉末是?,写出发生的氧化还原反应的离子方程式:?。
【探究延伸】
(4)经过实验分析.确定红色粉末为Fe2O3和Cu2O的混合物。实验小组欲利用该红色粉末制取较纯净的胆矾(CuSO4·5H2O)。经过查阅资料得知.在溶液中通过调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH如下: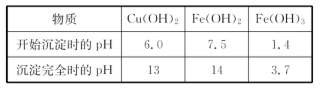
实验小组设汁如下实验方案: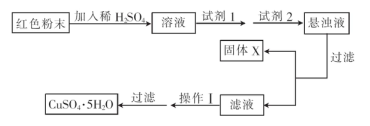
①试剂1为?.试剂2为?. (填字母)
A.氯水
B.H2O2
C.NaOH
D.CuO
②固体X的化学式为?。
③操作II为?。
4、选择题 类推思维是化学解题中常用的一种思维方法,下列有关离子方程式的类推正确的是
| ? | 已知 | 类推 |
| A | 将Fe加 入到CuSO4溶液中 入到CuSO4溶液中Fe + Cu2+ =" Cu" + Fe2+ | 将Na加入到CuSO4溶液中 2Na + Cu2+ =" Cu" + 2Na+ |
| B | 氢氧燃料电池的负极反应(稀硫酸作电解质溶液):H2 – 2e— = 2H+ | 氢氧燃料电池的负极反应(氢氧化钾溶液作电解质溶液):H2 – 2e— + 2OH—=2H2O |
| C | 用惰性电极电解CuSO4溶液 2Cu2++ 2H2O  4H+ + O2↑+ 2Cu 4H+ + O2↑+ 2Cu | 用惰性电极电解CuCl2溶液 2Cu2+ + 2H2O  4H+ + O2↑+ 2Cu 4H+ + O2↑+ 2Cu |
| D | 将少量CaCO3粉末投入足量盐酸中 CaCO3+ 2H+ = Ca2+ + H2O + CO2↑ | 将少量CaCO3粉末投入足量醋酸溶液中 CaCO3 + 2H+ = Ca2+ + H2O + CO2↑ 5、计算题 录像用的高性能磁粉,主要材料之一是由三种元素组成的化学式为CoxFe(3-x)O(3+x)的化合物。已知氧为-2价,钴(Co)和铁可能呈现+2价或+3价,且上述化合物中,每种元素只有一种化合价。则x值为______,铁的化合价______,钴的化合价________。 |