时间:2019-06-28 21:26:59
1、选择题 在一定温度下,一定量的水中,石灰乳悬浊液存在下列平衡:Ca(OH)2(s) Ca(OH)2(aq)
Ca(OH)2(aq) Ca2+(aq)+2OH-(aq),当向此悬浊液中加入少量生石灰时,下列说法正确的是(? )
Ca2+(aq)+2OH-(aq),当向此悬浊液中加入少量生石灰时,下列说法正确的是(? )
A.n(Ca2+)增大
B.c(Ca2+)不变
C.n(OH-)增大
D.c(OH-)减小
参考答案:B
本题解析:在石灰乳悬浊液存在下列平衡:Ca(OH)2(s) Ca(OH)2(aq)
Ca(OH)2(aq) Ca2+(aq)+2OH-(aq),当向此悬浊液中加入少量生石灰时,会发生反应:CaO+H2O= Ca(OH)2。由于消耗了溶剂水,所以Ca(OH)2会析出。n(Ca2+)、 n(OH-)减小,由于温度不变,所以c(Ca2+)、c(OH-)不变。因此选项为B。
Ca2+(aq)+2OH-(aq),当向此悬浊液中加入少量生石灰时,会发生反应:CaO+H2O= Ca(OH)2。由于消耗了溶剂水,所以Ca(OH)2会析出。n(Ca2+)、 n(OH-)减小,由于温度不变,所以c(Ca2+)、c(OH-)不变。因此选项为B。
本题难度:一般
2、填空题 “烂板液”是制印刷锌板时,用稀HNO3腐蚀锌板后得到的废液,主要含Zn(NO3)2和由自来水带进的Cl-、Fe3+等杂质离子.在实验室中由“烂板液”制取ZnSO4?7H2O的过程如下:
已知有关金属离子形成氢氧化物沉淀时的PH见下表:
| 离子 | 开始沉淀时的PH | 完全沉淀时的PH Fe3+ 1.9 3.2 Zn2+ 6.4 8.0 |
参考答案:(1)用SCN-检验Fe3+是否有剩余,故答案为:取少量上层清液,滴加KSCN溶液,若不出现血红色,表明Fe(OH)3 沉淀完全;
(2)过滤需要用到玻璃仪器有漏斗、玻璃棒、烧杯,故答案为:漏斗、玻璃棒、烧杯;
(3)第④步目的是使Fe3+完全沉淀,Zn2+不沉淀故应调节PH为3.2~6.4,故答案为:3.2~6.4;
(4)锌离子易水解生成氢氧化锌,酸性条件下可抑制锌离子的水解,故答案为:抑制Zn2+水解;
(5)操作⑦包括蒸发浓缩,冷却结晶,过滤,故答案为:蒸发浓缩;冷却结晶(或降温结晶).
本题解析:
本题难度:一般
3、选择题 已知25 ℃时,CaSO4在水中的沉淀溶解平衡曲线如图所示,向100 mL该条件下的CaSO4饱和溶液中加入400 mL 0.01 mol·L-1 Na2SO4溶液,下列叙述正确的是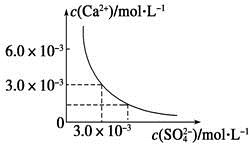
A.溶液中析出CaSO4固体沉淀,最终溶液中c(SO42-)比原来的大
B.溶液中无沉淀析出,溶液中c(Ca2+)、c(SO42-)都变小
C.溶液中析出CaSO4固体沉淀,溶液中c(Ca2+)、c(SO42-)都变小
D.溶液中无沉淀析出,但最终溶液中c(SO42-)比原来的大
参考答案:D
本题解析:由图知,Ksp(CaSO4)=c(Ca2+)·c(SO42-)=3.0×10-3×3.0×10-3=9×10-6,在CaSO4饱和溶液中c(Ca2+)=c(SO42-)=3.0×10-3 mol·L-1。加入400 mL 0.01 mol·L-1 Na2SO4溶液后,c(Ca2+)=6×10-4 (mol·L-1),=8.6×10-3(mol·L-1),Qc=c(Ca2+)·c(SO42-)=6×10-4×8.6×10-3=5.16×10-6<Ksp,所以没有(CaSO4沉淀析出,但溶液中c(SO42-)变大了,c(Ca2+)变小了,故只有D项正确。
本题难度:一般
4、选择题 已知:25 ℃时,CaCO3的Ksp=2.8×10-9,CaCO3在水中的溶解平衡曲线如图所示。下列说法正确的是
A.x数值为1.4×10-5
B.b点与d点对应的溶度积相等
C.加入蒸馏水可使溶液由d点变到a点
D.c点将有沉淀生成,平衡后溶液中c(Ca2+)、c(CO32-)一定相等
参考答案:B
本题解析:CaCO3在水中的沉淀溶解平衡为CaCO3(s) Ca2+(aq)+CO32-(aq),图象中位于曲线上的b、d点为饱和溶液,处于溶解平衡状态,a点处离子浓度小于饱和溶液浓度为不饱和溶液,c点为过饱和溶液,以此解答该题。A、在d点c(CO32-)=1.4×10-4?mol?L-1,因室温时,CaCO3的溶度积Ksp=2.8×10-9,所以c(Ca2+)=2×10-5?mol?L-1,故x的数值为2×10-5,故A不正确;B、b点与d点在相同的温度下,溶度积相等,故B正确;C、d点为饱和溶液,加入蒸馏水后变为不饱和溶液,则c(Ca2+)、c(CO32-)都减小,故不可能使溶液由d点变成a点,故C错误;D、在c点c(Ca2+)>2×10-5?mol?L-1,即相当于增大c(Ca2+),平衡左移,有CaCO3生成,但平衡后溶液中c(Ca2+)、c(CO32-)不一定相等,故D不正确,答案选B。
Ca2+(aq)+CO32-(aq),图象中位于曲线上的b、d点为饱和溶液,处于溶解平衡状态,a点处离子浓度小于饱和溶液浓度为不饱和溶液,c点为过饱和溶液,以此解答该题。A、在d点c(CO32-)=1.4×10-4?mol?L-1,因室温时,CaCO3的溶度积Ksp=2.8×10-9,所以c(Ca2+)=2×10-5?mol?L-1,故x的数值为2×10-5,故A不正确;B、b点与d点在相同的温度下,溶度积相等,故B正确;C、d点为饱和溶液,加入蒸馏水后变为不饱和溶液,则c(Ca2+)、c(CO32-)都减小,故不可能使溶液由d点变成a点,故C错误;D、在c点c(Ca2+)>2×10-5?mol?L-1,即相当于增大c(Ca2+),平衡左移,有CaCO3生成,但平衡后溶液中c(Ca2+)、c(CO32-)不一定相等,故D不正确,答案选B。
本题难度:一般
5、简答题 (15分)目前,全世界的镍消费量仅次于铜、铝、铅、锌,居有色金属第五位。镍行业发展蕴藏着巨大的潜力。镍化合物中的三氧化二镍是一种重要的电子元件材料和二次电池材料。工业上可利用含镍合金废料(除镍外,还含有Fe、Cu、Ca、Mg、C等杂质)制取草酸镍,然后高温煅烧草酸镍来制取三氧化二镍。
已知:①草酸的钙、镁、镍盐均难溶于水,且溶解度:NiC2O4> NiC2O4·H2O> NiC2O4·2H2O
②常温下,Ksp[(Fe(OH))3]=4.0×10-38,lg5=0.7
根据下列工艺流程图回答问题:
(1)加6%的H2O2时,温度不能太高,其目的是?。若H2O2在一开始酸溶时便与盐酸一起加入,会造成酸溶过滤后的滤液中增加一种金属离子,用离子方程式表示这一情况?。
(2)流程中有一步是调pH,使Fe3+转化为Fe(OH)3沉淀,常温下当溶液中c (Fe3+)=0.5×10-5mol/L时,溶液的pH=?。
(3)流程中加入NH4F的目的是?。
(4)将最后所得的草酸镍晶体在空气中强热到400℃,可生成三氧化二镍和无毒气体,写出该反应的化学方程式?。
(5)工业上还可用电解法制取三氧化二镍,用NaOH溶液调节NiCl2溶液的pH至7.5,再加入适量Na2SO4进行电解,电解产生的Cl2其80%的可将二价镍氧化为三价镍。写出Cl2氧化Ni(OH)2生成三氧化二镍的离子方程式?;将amol二价镍全部转化为三价镍时,外电路中通过电子的物质的量是?。
(6)近年来镍氢电池发展很快,它可由NiO(OH)跟LaNi5H6(LaNi5H6中各元素化合价均可看作是零)组成:6NiO(OH)+LaNi5H6 ?LaNi5+6Ni(OH)2。该电池放电时,负极反应是?。
?LaNi5+6Ni(OH)2。该电池放电时,负极反应是?。
参考答案:(15分)(1)减少过氧化氢的分解(1分)? Cu+ H2O2+2H+= Cu2++ 2H2O(2分)
(2)3.3(2分)
(3)除去Ca2+、Mg2+(2分)
(4)4(NiC2O4·2H2O)+3O2  2Ni2O3+8CO2+8H2O(2分)
2Ni2O3+8CO2+8H2O(2分)
(5)Cl2+2Ni(OH)2+2OH-=Ni2O3 +2Cl-+3H2O(2分)? 1.25a mol(2分)
(6)LaNi5H6+6OH--6e-=LaNi5+6 H2O(2分)
本题解析:(1)过氧化氢受热易分解,所以温度不能过高的原因是减少过氧化氢的分解;Fe、Ca、Mg均与盐酸直接反应,过氧化氢的加入造成酸溶过滤后的滤液中增加一种金属离子,则该金属离子只能是铜离子,所以反应的离子方程式为Cu+ H2O2+2H+= Cu2++ 2H2O;
(2)Ksp[(Fe(OH))3]=4.0×10-38=c(Fe3+)c(OH-)3,c(OH-)3=8×10-33mol/L,c(OH-)=2×10-11mol/L,所以c(H+)=5×10-4,lg5=0.7,所以pH=3.3;
(3)加入NH4F后的操作是过滤,说明该过程有沉淀产生,所以加入NH4F的目的是除去Ca2+、Mg2+;
(4)根据题目可知无毒气体是二氧化碳,
所以化学方程式为4(NiC2O4·2H2O)+3O2 ?2Ni2O3+8CO2+8H2O;
?2Ni2O3+8CO2+8H2O;
(5)根据氧化还原反应理论,Cl2氧化Ni(OH)2生成三氧化二镍,自身被还原为氯离子,化学方程式为Cl2+2Ni(OH)2+2OH-=Ni2O3 +2Cl-+3H2O;amol二价镍全部转化为三价镍时,需要氯气0.5amol,氯气的利用率是80%,则电解过程中的氯气是0.5amol/0.8,每生成1mol氯气转移2mol电子,所以外电路中通过电子的物质的量是0.5amol/0.8×2=1.25amol;
(6)NiO(OH)中Ni的化合价是+3价,Ni(OH)2中Ni是+2价,化合价降低,发生还原反应,所以放电时负极应发生氧化反应,LaNi5H6为负极反应物质,LaNi5H6中各元素化合价均可看作是零,所以化合价升高的只能是H元素,电极反应式为LaNi5H6+6OH--6e-=LaNi5+6 H2O。
本题难度:一般