时间:2019-06-28 21:23:52
1、计算题 如图装置中,容器甲内充入0.1 mol NO气体,干燥管内装有一定量Na2O2,从A处缓慢通入CO2气体.恒温下,容器甲中活塞缓慢由D向左移动,当移至C处时容器体积缩小至最小,为原体积的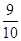 ,随着CO2的继续通入,活塞又逐渐向右移动。(不考虑活塞的磨擦)
,随着CO2的继续通入,活塞又逐渐向右移动。(不考虑活塞的磨擦)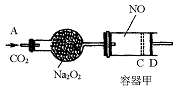
已知: 2Na2O2 + 2CO2 →? 2Na2CO3 + O2
(1)已知当活塞移至C处时,干燥管中物质的质量增加了2.24 g。
①此时,通入标准状况下的CO2气体多少L?
②容器甲中NO2转化为N2O4的转化率是多少?
③活塞移至C处后,继续通入a mol CO2,此时活塞恰好回至D处.则a值必?0.01(填大于、小于、等于),其理由是?。
(2)若改变干燥管中Na2O2的量,要通过调节甲容器的温度及通入的量CO2,使活塞发生从D到C,又从C到D的移动,则Na2O2的质量最小值应大于________g。
参考答案:(共16分)
(1)①CO2体积1.792 L;(3分)?②25%(4分)
③小于(2分);活塞移至C,体积不会再减少,则干燥管中Na2O2已反应完,活塞由C向D移动,体积扩大,2NO2 N2O4平衡左移,使二者物质的量增多,活塞移至D时,气体物质的量共增加0.01 mol,因此所需CO2必小于0.01 mol (3分)
N2O4平衡左移,使二者物质的量增多,活塞移至D时,气体物质的量共增加0.01 mol,因此所需CO2必小于0.01 mol (3分)
(2)1.56 g(4分)
本题解析:
(1)①设通入标准状况下CO2气体的体积为x,产生氧气的体积为y
2Na2O2+2CO2=Na2CO3+O2? Δm↑
2×22.4 L?22.4 L? 56 g
x?y? 2.24 g
56 g︰x=2×22.4 L×2.24 g
解得x=1.792L、y=0.896L
n(O2)=0.04mol
2NO+ O2=2NO2
2? 1? 2
0.08 mol?0.04 mol?0.08 mol
0.1 mol>0.08 mol
所以NO过量,生成NO2的物质的量为0.08 mol。
所以2NO2 N2O4?Δn↓
N2O4?Δn↓
2? 1? 1
0.02 mol? 0.1 mol×(1-9/10)=0.01mol
所以NO2转化为N2O4的转化率为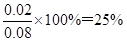
活塞移至C,体积不会再减少,则干燥管中Na2O2已反应完,活塞由C向D移动,体积扩大,2NO2 N2O4平衡左移,使二者物质的量增多,活塞移至D时,气体物质的量共增加0.01 mol,因此所需CO2必小于0.01 mol。
N2O4平衡左移,使二者物质的量增多,活塞移至D时,气体物质的量共增加0.01 mol,因此所需CO2必小于0.01 mol。
(2)实现从B→C的移动,只能通过降温使2NO2 N2O4的平衡向右移动(此反应为放热反应)。
N2O4的平衡向右移动(此反应为放热反应)。
即降温时2NO2 N2O4?Δn↓
N2O4?Δn↓
2? 1?1
0.02 mol? 0.1 mol×(1-9/10)
即容器中至少应有0.02 mol的NO2
根据转化关系式可知:2Na2O2→O2→2NO→2NO2
至少需要Na2O2? 0.02 mol
所以其质量最小值为0.02 mol×78 g/mol=1.56 g。2和过氧化钠反应的有关计算与判断
本题难度:一般
2、选择题 已知某饱和溶液的①溶液质量,②溶剂质量,③溶液体积,④溶质的摩尔质量,⑤溶质的溶解度,⑥溶液的密度。利用以上部分已知条件不能计算出该饱和溶液的物质的量的浓度的是( )
A.①②④⑥
B.②④⑤
C.①②③④
D.④⑤⑥
参考答案:B
本题解析:可根据物质的量浓度的定义及物质的量溶液、溶液密度、溶质的质量分数三者的关系确定。即:所用知识如下:
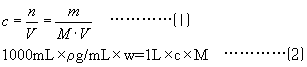
对于A:由①溶液质量和②溶剂质量之差可知溶质质量;结合④溶质的摩尔质量可知溶质的物质的量;由①溶液的质量和⑥溶液的密度可知溶液的体积。则由⑴可得物质的量浓度。
对于C:与A相似,只是用③直接给出了溶液的体积。
对于D:根据⑤可假设有水100g,则溶质的质量为S,结合④可得溶质的物质的量;由⑤的假设可知溶液的质量,结合⑥可知溶液的体积,从而能得到物质的量浓度。
本题难度:简单
3、选择题 氟气是氧化性最强的非金属单质,在加热条件下,等物质的量的氟气和稀氢氧化钠溶液完全反应,生成NaF、H2O和另一气体,该气体可能是
A.H2
B.HF
C.O2
D.OF2
参考答案:D
本题解析:根据原子守恒可知,该物质中F和O原子的个数之比是1︰1/2=2︰1,所以答案选D。
本题难度:一般
4、选择题 下列溶液中,氯离子浓度与200mL?1mol/L AlCl3溶液中氯离子浓度相等的是( )
A.250mL?1mol/L的NaCl溶液
B.50mL?2mol/L的NH4Cl溶液
C.100mL?3mol/L的KCl溶液
D.75mL?1mol/L的CuCl2溶液
参考答案:200mL?1mol/LAlCl3溶液中氯离子为1mol/L×3=3mol/L;
A、250mL?1mol/L的NaCl溶液中氯离子的浓度为1mol/L,故A错误;
B、50mL?2mol/L的NH4Cl溶液中氯离子的浓度为2mol/L=2mol/L,故B错误;
C、100mL?3mol/L的KCl溶液中氯离子的浓度为3mol/L,故C正确;
D、75mL?1mol/L的CuCl2溶液中氯离子的浓度为1mol/L×2=2mol/L,故D错误.
故选C.
本题解析:
本题难度:一般
5、填空题 某同学按下列步骤配制100mL?1.00mol/LNaCl溶液.
①计算所需NaCl固体的质量
②称量NaCl固体
③将称好的NaCl固体放入烧杯中,用适量蒸馏水溶解
④将烧杯中的溶液注入容量瓶(已检查是否漏液),并用少量蒸馏水洗涤烧杯2~3次,洗涤液也注入容量瓶
⑤向容量瓶中加蒸馏水至距刻度线1~2cm处
⑥将容量瓶盖紧,振荡,摇匀
请回答有关问题:
(1)用托盘天平称量固体NaCl的质量为______g.
(2)为了加速溶解,可以采取的措施是______.
(3)使用容量瓶的规格是______?mL.
(4)该同学实验中明显缺少的一步操作是______.
(5)如果将烧杯中的溶液转移到容量瓶时不慎洒到容量瓶外,最后配成的溶液中溶质的实际浓度比所要求______(填“大”或“小”)了.
参考答案:(1)m=CVM=1.00mol/L×0.1L×58.5g/mol=5.9g,故答案为:5.9g;?
(2)为了加速固体的溶解可以采用搅拌的方法,故答案为:搅拌;?
(3)实验室有100mL的容量瓶,所以应该使用100mL的容量瓶,故答案为:100mL;
(4)向容量瓶中加蒸馏水至距刻度线1~2cm处时要进行定容,定容的操作方法是:用胶头滴管滴加水至凹液面最低处与刻度线平齐,故答案为:改用胶头滴管滴加水至凹液面最低处与刻度线平齐;?
(5)根据C=nV知,将烧杯中的溶液转移到容量瓶时不慎洒到容量瓶外,导致溶质的物质的量偏小,则配制溶液的浓度偏小,故答案为:小.
本题解析:
本题难度:一般