时间:2019-06-28 21:23:52
1、选择题 相同质量的SO2和SO3,它们之间的关系是( )
A.所含硫原子的物质的量之比为1:1
B.氧原子的物质的量之比为3:2
C.氧元素的质量之比为5:6
D.硫元素的质量之比为4:5
参考答案:C
本题解析:
本题难度:一般
2、选择题 Na2SO4·10H2O的摩尔质量是?,483g Na2SO4·10H2O中所含Na2SO4·10H2O的物质的量是?,所含Na+的物质的量是??,所含H2O分子的数目是?个。
参考答案:(8分,每空2分)?
322g/mol,1.5mol, 3 mol ,?15NA(或9.03×1024)
本题解析:Na2SO4·10H2O的摩尔质量为:(23×2+32+16×4+10×18)g/mol=322g/mol;483g Na2SO4·10H2O中所含Na2SO4·10H2O的物质的量为:n=m÷M=483g÷322g/mol=1.5mol;Na+的物质的量为:2×1.5mol=3mol;所含H2O分子的数目为:1.5mol×10×NA =?15NA。
本题难度:一般
3、选择题 NA表示阿伏加德罗常数,下列说法正确的是
A.常温常压下,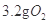 所含的原子数为0.2NA
所含的原子数为0.2NA
B.常温下11.2L甲烷气体所含的分子数为0.5NA
C.18gD2O所含的电子数为10NA
D.1.5molNO2与足量水反应,转移的电子数为1.5NA
参考答案:A
本题解析:A、常温常压下,3.2g氧气中O原子的数目是3.2g/16g/mol×NA=0.2NA,正确;B、常温下11.2L甲烷的物质的量不是0.5mol,所以含有的分子数不是0.5NA,错误;C、D2O的摩尔质量是20g/mol,所以18gD2O的物质的量不是1mol,则含有的电子数不是10NA,错误;D、二氧化氮与水反应中,二氧化氮既是氧化剂又是还原剂,则1.5mol二氧化氮中有1mol二氧化氮作还原剂,被氧化为硝酸,所以转移电子数是NA,错误,答案选A。
考点:考查阿伏伽德罗常数与微粒数的关系
本题难度:一般
4、计算题 (8分)在室温下,向100mL Cu(IO3)2饱和溶液中加入足量的经硫酸酸化的KI溶液,发生如下反应: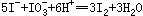 、
、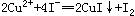 ,反应完全后,用0.1 mol/L的Na2S2O3溶液滴定,
,反应完全后,用0.1 mol/L的Na2S2O3溶液滴定,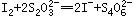 ,消耗了40 mL Na2S2O3溶液,计算:
,消耗了40 mL Na2S2O3溶液,计算:
(1)原饱和溶液中Cu(IO3)2的物质的量浓度;
(2)若Cu(IO3)2饱和溶液的密度为1.0 g/cm3,室温时Cu(IO3)2的溶解度是多少?
参考答案:(1)3.1×10-3 mol/L(2)0.13 g
本题解析:(1)1Cu(IO3)2?~? 6.5I2?~? 13Na2S2O3
1mol? 6.5mol? 13mol
C [Cu(IO3)2]·0.1L? 0.1 mol/L×0.04L
C [Cu(IO3)2]= 3.1×10-3 mol/L
(2)若Cu(IO3)2饱和溶液的密度为1.0 g/cm3,则100mL Cu(IO3)2饱和溶液为100g,其中Cu(IO3)2的质量为3.1×10-3 mol/L×0.1L×414g/mol="0.13" g,则室温时Cu(IO3)2的溶解度近似为0.13 g。
本题难度:简单
5、计算题 (6分)把2.56g纯铜放入盛有一定量浓硝酸的大试管中,立即发生反应,当铜反应完毕后,共生成1.12L气体(标况),计算反应中耗用硝酸的物质的量是多少?(要求写出计算过程)
参考答案:0.13mol
本题解析:n(Cu)=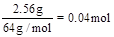 ,则溶液中的n(NO3-)=2n(Cu)=0.08mol。反应完毕后共生成1.12L气体,无论气体是NO还是NO2,消耗硝酸的量都为
,则溶液中的n(NO3-)=2n(Cu)=0.08mol。反应完毕后共生成1.12L气体,无论气体是NO还是NO2,消耗硝酸的量都为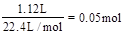 。根据原子守恒可知,反应中消耗硝酸的总量为0.05mol+0.08mol=1.3mol。
。根据原子守恒可知,反应中消耗硝酸的总量为0.05mol+0.08mol=1.3mol。
点评:硝酸与金属反应,硝酸在反应过程中一部分做氧化剂,变成气体,一部分起酸的作用,以NO3-的形式存在溶液中。
本题难度:一般