时间:2019-06-28 21:15:34
1、填空题 写出下列物质在水溶液中的电离方程式
氯化铜______
硫酸铁______
碳酸氢钠______
硫酸氢钠______.
参考答案:氯化铜是强电解质,电离时电离出自由移动的铜离子和氯离子,CuCl2=Cu2++2Cl-,
硫酸铁强电解质,电离时电离出自由移动的铁离子和硫酸根离子,Fe2(SO4)3=2Fe3++3SO42-,
碳酸氢钠在水中电离出钠离子和碳酸氢根离子,电离方程式为NaHCO3═Na++HCO3-,
NaHSO4是强电解质,NaHSO4在水中电离出钠离子和硫酸根离子和氢离子,NaHSO4═Na++H++SO42-,
故答案为:CuCl2=Cu2++2Cl-;Fe2(SO4)3=2Fe3++3SO42-;NaHCO3═Na++HCO3;NaHSO4═Na++H++SO42-.
本题解析:
本题难度:简单
2、选择题 常温下,将100 mL的0.02 mol·L-1的Ba(OH)2溶液和100 mL的0.02 mol·L-1的NaHSO4溶液混合,若忽略溶液体积变化,则混合后的溶液
A.pH=2
B.pH=12
C.由水电离产生的c(H+)=1.0×10-2mol·L-1
D.溶质的物质的量浓度为0.02mol·L-1
参考答案:B
本题解析:Ba(OH)2和 NaHSO41:1反应,方程式为 ;根据方程式,生成氢氧化钠的物质的量为0.002mol,浓度为0.01 mol·L-1,故B正确。
;根据方程式,生成氢氧化钠的物质的量为0.002mol,浓度为0.01 mol·L-1,故B正确。
考点:本题考查根据方程式的计算。
本题难度:一般
3、选择题 对H2O的电离平衡不产生影响的粒子是
[? ]
A.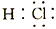
B.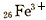
C.![]()
D.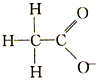
参考答案:C
本题解析:
本题难度:一般
4、选择题 25 ℃时,把1 mL0.1 mol/LH2SO4加水稀释制成2 L溶液,在此溶液中由水电离产生的H+接近于
A.1×10-4mol/L
B.2×10-10mol/L
C.5×10-11mol/L
D.1×10-10mol/L
参考答案:D
本题解析:
本题难度:困难
5、填空题 (9分)(1)Na2CO3的水溶液呈 (填“酸”、“中”、“碱”)性,常温时的pH 7(填“>”、“=”、“<”),原因是(用离子方程式表示): ; (2)氯化铝水溶液呈 性,原因是(用离子方程式表示):_____________________ 。
把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是 。
参考答案:(1)碱性;(1分) > (1分); CO32-+H2O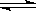 HCO3-+OH-(2分)
HCO3-+OH-(2分)
(2)酸性;(1分) Al3++3H2O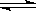 Al(OH) 3+3H+ (2分) ;Al2O3 (2分)
Al(OH) 3+3H+ (2分) ;Al2O3 (2分)
本题解析:(1)碳酸钠是强碱弱酸盐,水解显碱性,显÷常温下pH大于7,水解方程式为CO32-+H2O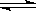 HCO3-+OH-。
HCO3-+OH-。
(2)氯化铝是强酸弱碱盐,水解显酸性,水解方程式为Al3++3H2O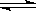 Al(OH) 3+3H+。由于水解是吸热的,而生成物氯化氢又易挥发,所以最终得到是氢氧化铝沉淀,灼烧得到氧化铝。
Al(OH) 3+3H+。由于水解是吸热的,而生成物氯化氢又易挥发,所以最终得到是氢氧化铝沉淀,灼烧得到氧化铝。
本题难度:一般