时间:2019-06-28 21:09:25
1、选择题 I.下图是中学教材中铜与稀硝酸反应的实验装置,请就此回答下列问题:
(1)管A中发生反应的离子方程式是?。
⑵试管A中观察到的现象是?。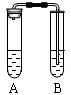
⑶试管B中盛装NaOH溶液的目的是?。
II.上述装置存在明显的不足,为克服上述缺点,某课外小组的学生设计了如图所示的装置。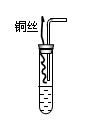
实验步骤如下:①检查装置的气密性;②向试管中加入一定量碳酸
钙固体;③向试管中加入过量稀硝酸,并迅速盖上带铜丝和导管的
橡皮塞;④待反应完全后,将导管插入试管内接近液面(如图);
⑤将铜丝插入到溶液中;⑥反应一段时间后,用注射器向试管内
推入氧气(或空气)。
请回答下列问题:
⑷实验中加入CaCO3的作用是?。
⑸实验④的实验目的是??。
⑹实验⑥中推入氧气或空气的目的是?。
2、实验题 ( 17分)欲配制1 mol/L的氢氧化钠溶液250mL,
(1)实验室所需的仪器有:?,?,?,?,?。
(2)完成下列步骤:
①称取氢氧化钠固体?克。
②将称好的氢氧化钠固体放入?中,加少量蒸馏水将其溶解,待冷却后将溶液沿?移入?中。
③用少量蒸馏水洗涤?次,将洗涤液转移入?中,在操作过程中不损失点滴液体,否则会使溶液的浓度偏?(高或低)。
④加水定容过程中离刻度线?时,改用?小心地加水至溶液凹液面与刻度线相切,若加水超过刻度线,会造成溶液浓度偏?,应该?。
⑤最后盖好瓶盖,?,将配好的溶液移入试剂瓶中并贴好标签。
3、简答题 下图是甲、乙、丙三名同学设计的验证铜和浓硝酸反应原理的装置
已知:2NO2+2NaOH═NaNO3+NaNO2+H2O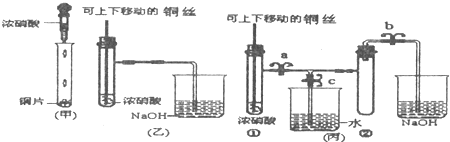
(1)写出铜和浓硝酸反应的离子反应方程式是______.
(2)和甲同学装置相比,乙同学设计的装置的优点是______、______.
(3)为了进一步验证NO2和水的反应,某学生设计了丙装置.
先关闭弹簧夹______(填a或b或c),再打开弹簧夹______和______(填a或b或c),才能使NO2气体充满②试管.
(4)当气体充满②试管后,将铜丝提起与溶液脱离,欲使烧杯中的水进入②试管.应如何操作______.
(5)某位同学的实验中未得到蓝色的溶液,而呈绿色,他分析可能是生成的部分NO2溶解在溶液中造成的.请你帮他设计简单实验方案验证他的推测.
4、选择题 下列实验能获得成功的是(?)
A.苯和浓溴水用Fe作催化剂制溴苯
B.氯乙烷与NaOH溶液共热,水解后加入AgNO3溶液检验Cl-
C.CH4和Cl2光照制得纯净的CH3Cl
D.乙烯通入含Br2的CCl4溶液制得CH2BrCH2Br
5、选择题 下列实验操作的先后顺序合理的是(?)
A.制取乙酸乙酯,应先将乙醇、乙酸混合,后加入到浓硫酸中
B.酸碱中和滴定中,应先将锥形瓶用待测液润洗,后加入一定体积的待测液
C.配制SnCl2溶液时,应先将SnCl2固体溶于浓盐酸中,后加水稀释
D.用分液漏斗滴液,应先旋开分液漏斗的活塞,后打开漏斗上口的玻璃塞